Химическая реакция – процесс, при котором из одних веществ
получаются другие. Как известно, по признаку процесса различают несколько типов
реакций: разложения, замещения и т. д. По характеру обратимости реакции делятся
на обратимые и необратимые. Реакции, протекающие в одном направлении и
приводящие к полному превращению исходных веществ в продукты реакции,
называются необратимыми:
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
Обратимыми называются реакции, которые одновременно идут в двух
взаимно противоположных направлениях: слева направо – прямая, справа налево –
обратная. Обе реакции идут с определенной скоростью. В ходе обратимой реакции
концентрация исходных веществ уменьшается, а концентрация продуктов реакции
увеличивается. Соответственно скорость прямой реакции будет уменьшаться, а
обратной – увеличиваться до тех пор, пока эти скорости не станут равными.
Состояние системы, при котором скорость прямой реакции равна скорости обратной,
называется химическим равновесием. При состоянии химического
|
|
|
равновесия реакция не прекращается, а обе реакции идут с равными скоростями
Выразим скорости прямой и обратной реакций:
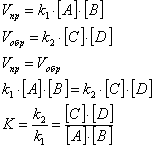
К – константа химического равновесия.
Полученное уравнение выражает закон “Действующих масс” для химического
равновесия. При установившемся химическом равновесии отношение произведения
концентраций продуктов реакции к произведению концентраций исходных веществ
есть величина постоянная при определенных условиях. Физический смысл
константы химического равновесия состоит в том, что она показывает во сколько
раз прямая реакция идет быстрее обратной. Если K>1, то преобладает прямая
реакция, если K<1 – обратная. Это положение дает возможность не только
определить направление реакции, но и регулировать любой химический процесс,
смещая его в ту или иную сторону.
При изменении температуры, давления или концентрации регентов равновесие
может сместиться. Изменения, происходящие в системе в результате внешних
воздействий, определяются принципом «подвижного равновесия» или принципом Ле-
Шателье:
Внешние воздействия на систему, находящуюся в состоянии химического
равновесия, приводят к смещению этого равновесия в направлении, при котором
ослабевает эффект произведенного воздействия.
[c]: при увеличении концентрации одного из реагирующих веществ равновесие
сместится в сторону расхода вводимого вещества, при уменьшении концентрации
равновесие сместится в сторону образования этого вещества.
[t]: при повышении температуры равновесие сместится в стороны
эндотермической реакции, при понижении – в сторону экзотермической реакции.
|
|
|
[p]: при увеличении давления равновесие сместится в сторону уменьшения
газообразных веществ, при уменьшении – в сторону увеличения газообразных
веществ. Если реакция протекает без изменения числа молекул газообразного
вещества, то давление не влияет на химическое равновесие.
 2015-07-14
2015-07-14 1616
1616
