Термодинамические системы (ТС) в общем случае являются неоднородными. Они могут состоять из тел различного химического состава и находиться в различных агрегатных состояниях. При этом между телами ТС могут протекать различные химические реакции (ХР) и переходы веществ из одних фаз в другие. Характерным признаком неоднородных ТС является перераспределение масс веществ, входящих в ТС, в результате протекания ХР и фазовых переходов. Масса, или количество вещества, играет роль координаты состояния в этих процессах. Процессы перераспределения массы могут протекать и в системах, полностью изолированных от окружающей среды при создании необходимых условий.
Химические превращения принято рассматривать при условиях: Т, р=const и T, V=const.
Поэтому в химической термодинамике используются только две характеристические функции: F и G (свободная энергия Гельмгольца F и свободная энергия Гиббса G). Чаще на практике используется свободная энергия Гиббса.
На направление протекания ХР влияют начальные (исходные) концентрации реагентов, температура Т и давление р. Самопроизвольно ХР протекает до достижения химического равновесия между реагентами, при котором состав смеси с течением времени не изменяется при заданных условиях сопряжения ТС с окружающей средой. Химическое равновесие является динамическим равновесием.
Степень отклонения ХР от равновесия определяется химическим сродством, т.е. способностью реагентов вступать в ХР друг с другом.
Химическим сродством А называется максимальная работа ХР в обратимом процессе длиной в один пробег ХР.
Определим условия химического равновесия, исходя из объединенного выражения 1-го и 2-го законов термодинамики в записи через свободную энергию Гиббса для обратимых процессов в сложной закрытой (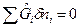 )
) 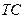 :
:
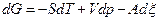 .
.
Тогда при фиксации р и Т получим:
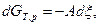
отсюда химическое сродство А равно
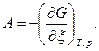 (1)
(1)
Уменьшение величины свободной энергии Гиббса dGT,p является мерой химического сродства реагентов. Для ТС, в которой протекает одна химическая реакция 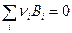 свободная энергия Гиббса равна
свободная энергия Гиббса равна
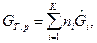 (2)
(2)
где 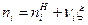 . Тогда
. Тогда
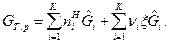 (3)
(3)
После дифференцирования (3) по 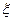 имеем:
имеем:
 , или
, или 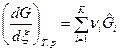 . (4)
. (4)
Подставив (4) в (1), получим:
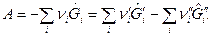 [Дж/моль] (5)
[Дж/моль] (5)
По (5) проводится расчет химического сродства смесей идеальных и реальных газов и растворов для любых фазовых состояний. Химическое сродство А является функцией состояния термодинамической системы.
Если система находится в равновесии, то А =0, так как
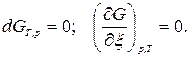
Параметры системы в момент равновесия обозначаются символом *. При отклонении химической реакции от состояния равновесия  Тогда из выражения (1) следует, что при отклонении ХР вправо от состояния равновесия
Тогда из выражения (1) следует, что при отклонении ХР вправо от состояния равновесия 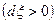 химическое сродство А <0, а при отклонении ХР влево от состояния равновесия (
химическое сродство А <0, а при отклонении ХР влево от состояния равновесия (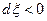 )химическое сродство А >0, как это иллюстрируется на следующих рисунках:
)химическое сродство А >0, как это иллюстрируется на следующих рисунках:
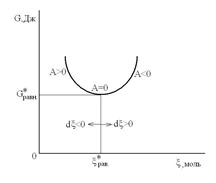
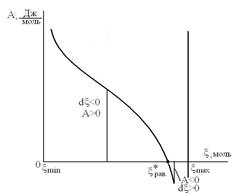
При приближении к предельным значениям пробега химической реакции (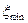 и
и 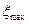 ) химическое сродство А стремится к ± ∞, поскольку один из реагентов в левой или правой частях уравнения ХР исчезает. При этом молярная доля этого реагента стремится к нулю.
) химическое сродство А стремится к ± ∞, поскольку один из реагентов в левой или правой частях уравнения ХР исчезает. При этом молярная доля этого реагента стремится к нулю.
В этом случае 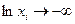 и молярная свободная энергия Гиббса
и молярная свободная энергия Гиббса
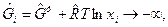
а, следовательно, химическое сродство А → 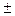 ∞.
∞.
 2015-01-21
2015-01-21 2328
2328
