Раствором называют гомогенную систему переменного состава, состоящую из
двух и более компонентов. Каждый из компонентов раствора равномерно распределен
в массе другого в виде молекул, атомов или ионов. Растворы бывают газообразные,
жидкие и твердые. Практически наиболее важны жидкие растворы. Условно
компоненты раствора делятся на растворенные вещества и
растворитель. Если раствор образуется при смешивании компонентов одинакового
агрегатного состояния, растворителем считается компонент, которого в растворе
больше. В остальных случаях растворителем является тот компонент, агрегатное
состояние которого не меняется при образовании раствора. При растворении
происходит взаимодействие растворенного вещества и растворителя, называемое
сольватацией, в случае водных растворов – гидратацией. Растворение
в жидкостях газов и жидкостей сопровождается обычно выделением теплоты
(ΔH<0); растворение твердых веществ в большинстве случаев – процесс
эндотермический (ΔH>0). Энтропия при растворений твердых веществ, как
правило, увеличивается (ΔS>0), газов – уменьшается (ΔS<0).
Растворимостью называется способность вещества растворяться в том или
ином растворителе. Мерой растворимости вещества приданных условиях
является содержание его в насыщенном растворе. Раствор называется
насыщенным, если он находится в равновесии с растворяемым веществом
(ΔG=0), т.е. в насыщенном растворе содержится предельное при данных
условиях количество растворенного вещества. Раствор, содержащий вещества
больше, чем это определяется его растворимостью, - пересыщенный,
раствор, содержащий вещества меньше, чем это определяется его растворимостью, -
ненасыщенный. На практике растворимость твердых веществ часто выражают
величиной, называемой коэффициентом растворимости, который показывает
массу безводного вещества, насыщающую 100 г растворителя при данной
температуре. Растворимость вещества зависит от природы растворяемого вещества и
растворителя, их агрегатного состояния, наличия в растворе посторонних веществ,
температуры, а в случае газообразного растворяемого вещества – и от давления.
Согласно правилу «подобное растворяется в подобном», ионные соединения
и молекулярные с полярным типом связи лучше растворяются в полярных
растворителях, неполярные вещества – в неполярных растворителях. При повышении
температуры растворимость газов обычно уменьшается. Растворимость твердых
веществ меняется по-разному, что определяется знаком теплового эффекта процесса
растворения: растворение большинства твердых веществ – процесс эндотермический
(ΔH>0), поэтому с повышением температуры растворимость их
увеличивается. Влияние давления на растворимость газов в жидкостях выражает
закон Генри:
| Растворимость газа при постоянной температуре прямо пропорционально его парциальному давлению над раствором: x = k∙p |
где x – молярная доля растворенного вещества в насыщенном растворе;
k – коэффициент пропорциональности, называемый константой
(коэффициентом) Генри; р – парциальное давление.
Закон Генри справедлив для случая сравнительно разбавленных растворов,
невысоких давлений и отсутствия химического взаимодействия между молекулами
растворяемого газа и растворителя.
Присутствие посторонних веществ, как правило, уменьшает растворимость данного
вещества. Уменьшение растворимости веществ в присутствии солей называется
высаливанием. Растворимость малорастворимых электролитов уменьшается при
введении в насыщенный раствор одноименных ионов.
На практике состав растворов выражают с помощью следующих величин:
безразмерных – массовая и молярная доли и размерных – молярная концентрация
вещества, молярная концентрация вещества эквивалента, моляльность и массовая
концентрация вещества.
Массовая доля растворенного вещества w – отношение массы растворенного
вещества m1 к общей массе m:
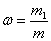
Массовая доля выражается в процентах и в долях единицы.
Молярная доля i-го компонента раствора xi – отношение
количества вещества данного компонента к общему количеству вещества раствора.
Для бинарного раствора:
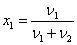
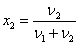
Молярная доля также выражается в процентах и в долях единицы.
Моляльность раствора b(X) – отношение количества растворенного вещества Х
к массе растворителя m:
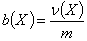
Моляльность выражается в моль/кг.
Молярная концентрация вещества в растворе частиц Х с(Х) – отношение
количества вещества к объему раствора:
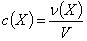
Молярная концентрация выражается в моль/л.
Молярная концентрация вещества эквивалента (1/z*)X в растворе c[
(1/z*)X ] – отношение количества растворенного вещества эквивалента (1/z*)X к
объему раствора:
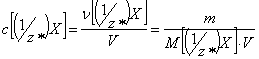
Она выражается в моль/л.
Массовая концентрация вещества Х в растворе Т(Х) – отношение
массы растворенного вещества Х к объему раствора:
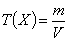
Массовая концентрация выражается в г/л.
 2015-07-14
2015-07-14 717
717








