Взаимодействие с растворителем растворенного вещества может вызвать распад
последнего на ионы. Распад растворенного вещества на ионы под действием молекул
растворителя называется электролитической диссоциацией или
ионизацией веществ в растворах.
Возможность и степень распада растворенного вещества на ионы определяется
природой растворенного вещества и растворителя. Электролитической диссоциации
подвергаются ионные соединения и молекулярные соединения с полярным типом
связи в полярных растворителях. Вода относится к наиболее сильноионизирующим
растворителям.
Вещества, распадающиеся в растворах или расплавах на положительно заряженные (
катионы) и отрицательно заряженные (анионы) ионы, называются
электролитами. Электролитами являются кислоты, основания, соли.
Ионы в растворе сольватированы (гидратированы), т.е. окружены оболочкой из
молекул растворителя. Катионы К связаны с молекулами воды гидратной оболочки
донорно-акцепторной связью и являются акцепторами электронных пар; доноры –
атомы кислорода Н2О.
Анионы А – связаны с молекулами Н2О либо кулоновскими силами, либо
водородной связью, при образовании которой они – доноры электронных пар.
Схематически гидратную оболочку ионов можно изобразить следующим образом:


Обычно пользуются упрощенными уравнениями электролитической диссоциации, в
которых гидратная оболочка ионов не указывается.
По степени диссоциации α в растворах электролиты подразделяют на
сильные и слабые:
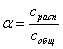
Степень диссоциации выражают в долях единицы или процентах. Электролиты, у
которых α<1, относятся к слабым, у сильных электролитов α
= 1.
К сильным электролитам в водных растворах принадлежат почти все соли, многие
неорганические кислоты, гидроксиды щелочных и щелочноземельных металлов.
Сильные электролиты в водных растворах распадаются на ионы полностью. Их
истинная степень диссоциации не зависит от концентрации раствора.
Диссоциация слабых электролитов - обратимый процесс. Для диссоциации слабого
бинарного электролита КА
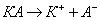
на основании ЗДМ справедливо соотношение:
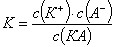
Константу равновесие К в данном случае называют константой ионизации.
Согласно закону разбавления Оствальда, константа диссоциации бинарного
электролита связана со степенью диссоциации соотношением:
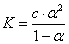
Это уравнение выражает зависимость степени диссоциации от концентрации раствора.
Если α<<1, то
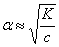
Иными словами, закон Оствальда гласит: с уменьшением концентрации
раствора степень диссоциации слабого электролита увеличивается. В
соответствии с принципом Ле-Шателье введение в раствор слабого электролита
одноименных ионов уменьшает степень его диссоциации. При уменьшении
концентрации одного из ионов диссоциация слабого электролита усиливается.
Вода является очень слабым амфотерным электролитом: К = 1,8·10-16.
В воде и разбавленных водных растворах электролитов значения концентрации и
активности практически совпадают, а с(Н2О) практически постоянна. Поэтому можно
считать постоянным ионное произведение воды (произведение концентраций
водородных ионов и гидроксид-ионов при данной температуре для воды и
разбавленных водных растворов) KW(KH2O): KW =
K∙c(H2O) = c(H+)∙c(OH-). При 25°С Kw =
10ˉ14 моль² /л². При увеличении температуры Kw
значительно возрастает. В любом растворе одновременно присутствуют Н+
и ОН– ионы. Кислотность и щелочность среды обычно характеризуют
концентрацией водородных ионов или водородным показателем рН. Он равен
десятичному логарифму концентрации водородных ионов, взятому с обратным знаком:
pH = - lgc(H). Значение рН может быть больше 14 и быть отрицательным.
Приближенно реакцию среды определяют с помощью специальных реактивов –
индикаторов.
 2015-07-14
2015-07-14 563
563








