| № реакции | Анион | Выполнение реакции | Аналитический эффект |
SO 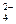
| На фильтровальную бумагу нанося 1 каплю 2Н раствора BaCl2 и каплю раствора родизоната натрия. Образовавшееся пятно смачивают 1 каплей анализируемого раствора | Красное пятно обесцвечивается | |
SO 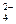
| К 1-2 каплям анализируемого раствора прибавляют 3-4 капли 6Н раствора НСl и 1-2 капли 2Н раствора BaCl2 | Выпадает белый кристаллический осадок сульфата бария, нерастворимого в кислотах и щелочах | |
SO 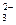
| К 5 каплям раствора прибавляют 2 капли 2Н раствора BaCl2 | Выпадает белый кристаллический осадок сульфита бария, хорошо растворимый в кислотах | |
SO 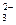
| К 5 каплям раствора прибавляют 1-2 капли раствора иода (5%-ного) | Раствор иода обесцвечивается | |
СО 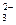
| К 5 каплям раствора прибавляют 2 капли 2Н раствора BaCl2 | Выпадает белый кристаллический осадок карбоната бария, хорошо растворимый в кислотах | |
PO 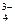
| % капель анализируемого раствора помещают в маленький тигель, туда же прибавляют 2 капли конц. Азотной кислоты и смесь выпаривают досуха. К остатку прибавляют 2 капли конц.HNO3, 0.1г кристаллического NH4NO3, 10 капель молибденовой жидкости и нагревают до 40-500С | Выпадает желтый кристаллический осадок фосфоромолибдата аммония, легко растворимый в аммиаке | |
| Cl- | К 5 каплям раствора прибавляют 3 капли 6Н раствора азотной кислоты и 3 капли раствора AgNO3 | Выпадает белый творожистый осадок, растворимый в аммиаке и тиосульфате натрия | |
| Br- | К 5 каплям раствора прибавляют 3-5 капель свежеприготовленной хлорной воды и 0.5мл бензола. Содержимое пробирки хорошо встряхиваюти дают отстояться водному слою | Слой бенэола окрашивается бромом в красно-бурый цвет | |
| J- | К 5 каплям раствора прибавляют 3-5 капель свежеприготовленной хлорной воды и 0.5мл бензола.Хорошо встряхивают и дают водному слою отстояться | Сло бензола иодом окрашивается в фиолетовый цвет | |
| S2- | К 5 каплям раствора прибавляют 5 капель 5%-ного раствора CdCl2 и 1-2 капли 2Н раствора HCl | Выпадает осадок сульфида кадмия канареечно-желтого цвета | |
NO 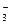
| 2-3 капли раствора помещают на часовое стекло. В раствор опускают кристаллик FeSO4 и добавляют 1 каплю конц.H2SO4 | На границе раздела жидкостей появляется бурое кольцо, хорошо видимое на белом фоне | |
NO 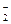
| 2-3 капли анализируемого раствора помещают на часовое стекло. Прибавляют 1-2 капли 2Н раствора уксусной кислоты и 5 капель свежеприготовленного реактиа Грисса; перемешивают и оставляют стоять в прохладном месте 5-10мин. | Раствор окрашивается в зависимости от содержания нитрит-иона в желто-коричневый или красный цвет | |
| СН3СОО- | 5 капель раствора помещают в пробирку, прибавляют 4 капли конц. H2SO4 и 5 капель амилового спирта. Содержимое пробирки перемешивают, нагревают на водяной бане 2-3 мин. и выливают в холодную воду. | Характерный запах грушевой эссенции (амилацетат) | |
| СН3СОО- | 2-3 капли раствора помещают в пробирку, прибавляют 5 капель 10%-ного раствора FeCl3, разбавляют водой в два раза и нагревают | Выпадает бурый осадок основного ацетата железа |
При анализе индивидуального вещества могут быть использованы качественные реакции на катионы и анионы не указанные в таблицах.
 2015-07-14
2015-07-14 450
450







