Рассмотрим один из распространённых случаев электрохимической коррозии - процессы, происходящие при наличии контакта двух металлов, помещенных в раствор электролита. Такую пару металлов (М1 и М2) называют гальванопарой и обозначают М1/М2. В качестве коррозионной среды примем воду, раствор кислоты или щёлочи при отсутствии или наличии растворённого кислорода. Упрощенное описание коррозионного процесса с участием конкретных гальванопар рассмотрим на примерах.
Пример 1. Рассмотрите процесс коррозии луженого (покрытого оловом) железа при условии нарушения сплошности покрытия в кислой среде в отсутствии растворенного кислорода.
Решение. При условии нарушения сплошности покрытия образуется гальванопара 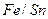 .
.
· 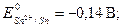
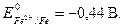
· Fe – металл с меньшим потенциалом - анод гальванопары. Оно будет восстановителем, окисляться, т.е. отдавать электроны. (Полезно для запоминания обратить внимание на первые буквы слов: а нод, о кисление, о тдача - слова начинаются с гласных букв).
· Sn – металл с большим потенциалом в данной среде - катод гальванопары. На поверхности катода происходит восста-новление окислительного компонента коррозионной среды, присоединение электронов. (Для запоминания: слова к атод, в осстановление, п рисоединение начинаются с согласных букв).
· Возможный окислитель – ионы водорода кислоты, 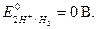
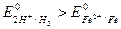 , т.е. коррозия железа возможна.
, т.е. коррозия железа возможна.
· Электронно-ионная схема:

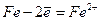 - анодный процесс
- анодный процесс

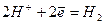 - катодный процесс (на Sn)
- катодный процесс (на Sn)
 |
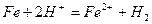
· Молекулярное уравнение: 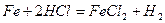 .
.
Пример 2. Рассмотрите процесс коррозии с кислород-ной деполяризацией во влажном воздухе гальванопары Mg/Fe.
 2015-07-14
2015-07-14 421
421








