ЛЕКЦИЯ
КОРРОЗИЯ МЕТАЛЛОВ
Основные понятия и определения
· Коррозия – это самопроизвольное разрушение металла в результате его взаимодействия с окружающей средой.
Термином "металл" будем обозначать, наряду с чистым металлом, сплав или металлический материал. При коррозии окисляется металл и восстанавливается окислительный компонент среды, т.е. коррозия – это окислительно-восстановительный процесс.
· По механизму протекания коррозионного процесса выделяют химическую и электрохимическую коррозию.
Химическая коррозия проходит в среде неэлектролита, путем непосредственного перехода электронов от атомов ме-талла к окислителю. Такой механизм наблюдается при взаи-модействии металлов с агрессивными газами при высоких тем-пературах (газовая коррозия) и с органическими жидкими не-электролитами. Газовой коррозии подвергается режущий ин-струмент при большой скорости обработки металлов, элементы реактивных двигателей и т.д. Пример коррозии в среде жидкого неэлектролита - разрушение деталей двигателей внутреннего сгорания.
Электрохимическая коррозия проходит в среде элек-тролита, её отличительная особенность - разделение в про-странстве процессов окисления и восстановления. Электрохи-мическая коррозия более распространена, ей подвергаются металлические конструкции в почвенных, речных и морских водах, в растворах солей, кислот, щелочей, в атмосфере под плёнками влаги. Необходимым условием осуществления электрохимической коррозии является наличие разности потенциалов участков корродирующей металлической поверхности.
Основные причины появления разности потенциалов (а таким образом, и электрохимической коррозии) –
· контакт разнородных металлов,
· микронапряжения в металлическом изделии,
· неоднородность механической или термической обработки металлической поверхности,
· наличие неметаллических включений (графита, карбидов, пятен краски на поверхности и т.д.).
Анодный и катодный процессы
при электрохимической коррозии
При электрохимической коррозии выделяют два взаимосвязанных процесса: анодный и катодный.
· Анодный процесс – окисление металла, происходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки разрушаются.
· Катодный процесс – восстановление окислителя, находящегося в растворе или расплаве электролита, происходит на участках изделий с большим потенциалом в данной среде. Катодные участки химически не изменяются. Они служат проводниками электронов от анодных участков к окислителю, чем усиливают коррозию анодных участков. Более подробно это будет рассмотрено далее на конкретных примерах.
Окислители при коррозии принято называть деполяризаторами. Коррозию с участием наиболее распространённых окислителей - растворённого кислорода и ионов водорода (кислоты или воды) соответственно называют коррозией с кислородной и водородной деполяризацией. Уравнения катодных процессов при коррозии с водородной и кислородной деполяризацией приведены в таблице.
| Уравнения катодного процесса | |
| в отсутствие растворенного кислорода (с водородной деполяризацией) | в присутствии растворенного кислорода (с кислородной деполяризацией) |
| кислая среда | |
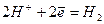 (1) (1)
| 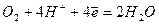 (3) (3)
|
| нейтральная и щелочная среда | |
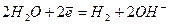 (2) (2)
| 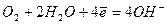 (4) (4)
|
Окислительно-восстановительные потенциалы кислоро-да и водорода в различных средах (точнее, соответствующих окислительно-восстановительных пар) приведены в таблице. Ранее отмечали: чем больше значение потенциала окислитель-но-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары. Поэтому окислительные свойства кислорода выше окислительных свойств иона водорода (или воды). Известно, что при рН³7, т.е. в нейтральных и щелочных растворах, процесс обычно протекает с кислородной деполяризацией - уравнение (4), в кислых средах – преимущественно с водородной деполяризацией - уравнение (1). На практике окислителями одновременно могут выступать и ионы водорода, и кислород, т.е. процесс может проходить с водородно-кислородной деполяризацией.
Коррозия, как и любой окислительно-восстановитель-ный процесс, может осуществляться только в тех случаях, когда потенциал окислителя больше потенциала восстано-вителя - металла анодных участков:
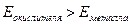 .
.
 2015-07-14
2015-07-14 409
409







