В потенциометрическом методе анализа используют два основных класса электродов:
– электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные);
– электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными, или ионообменными, их называют также ионоселективными.
Обратимые электроды – электроды, у которых скачки потенциалов зависят от концентрации в соответствии с термодинамическими уравнениями. На обратимых электродах быстро устанавливается равновесие, и скачки потенциалов остаются неизменными во времени. При прохождении электрического тока скачки потенциалов не должны значительно изменяться; а после выключения тока быстро должно устанавливаться равновесие. Электроды, не удовлетворяющие этим требованиям, называются необратимыми. В потенциометрии используют обратимые электроды.
Электроды I рода – электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод – металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+; Cu/Cu2+ и т. д.
В качестве электрода сравнения используют стандартный водородный электрод – электрод I рода – Pt(H2)/2H+. Его потенциал определяется величиной pH и при комнатной температуре равен:
E = E0 + 0,059lg[H+] = −0,059pH. (28)
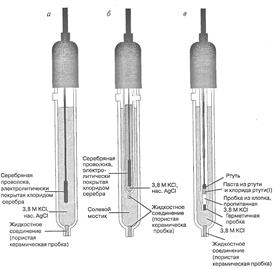
Стандартный водородный электрод неудобен в работе, его заменяют электродами II рода – насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.) (рис.18, а - в).
 | |||
| |||
Электроды II рода – электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли.
х.с.э. н.к.э.
Ag |AgCl |Cl- Hg | Hg2Cl2 |Cl−
Концентрация Cl− поддерживается на определенном уровне путем добавления раствора хорошо растворимой соли с тем же анионом (чаще KCl). Отличительной особенностью электродов сравнения, применяемых в аналитической практике, является простота изготовления (доступность), воспроизводимость потенциала и низкий температурный коэффициент. Этим требованиям отвечают х.с.э. и н.к.э.
Хлорсеребряный электрод (х.с.э.) – электрод, чувствительный к анионам Cl−, которые образуют осадки с катионами металла электрода (Ag+). Он представляет собой серебряную проволоку, покрытую равномерным слоем AgCl, который хорошо проводит электрический ток (рис.18, а, б). Проволоку погружают в насыщенный раствор КСl. В растворе устанавливается равновесие
AgCl(тв) + e → Ag(тв) + Cl−,
т.е. его потенциал определяется концентрацией Cl− – ионов. Потенциал данного хлорсеребряного электрода равен +0,201 В. При концентрации КСl 0,1 н он равен +0,29 В, а при 1,0 н – 0,24 В.
Насыщенный каломельный электрод (н.к.э.) изготовлен на основе металлической ртути и каломели Hg2Cl2 (рис.18, в). Электрохимическое уравнение, характеризующее поведение электрода, описывается полуреакцией
Hg2Cl2 + 2e- → 2Hg + 2Cl−.
Так же, как и в случае х.с.э. потенциал зависит от концентрации Cl− –ионов. При использовании в качестве электролита насыщенного раствора КСl, потенциал электрода равен +0,244 В. Для 1 н раствора KCl E = 0,280 В; для 0,1 – 0,334 В.
Ионоселективные электроды – это электроды, обратимые по катионам или анионам, сорбируемыми твердой или жидкой мембраной. Они делятся на группы:
· стеклянные электроды;
· твердые электроды с гомогенной или гетерогенной мембраной;
· жидкостные электроды (на основе ионных ассоциативов, хелатов металлов или нейтральных лигандов);
· газовые электроды;
· электроды для измерения активности (концентрации) биологических веществ.
Мембранные электроды имеют форму пластинок из ионообменного материала, контактирующих с двумя растворами электролита МХ1(с1)/мембрана/ МХ2(с2).
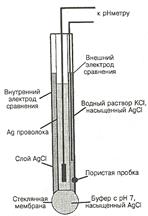 Среди ионоселективных электродов наибольшее применение получил стеклянный электрод, предназначенный для измерения рН (рис.19).
Среди ионоселективных электродов наибольшее применение получил стеклянный электрод, предназначенный для измерения рН (рис.19).
 Стеклянный электрод – это несколько условное название несложной системы, включающей небольшой сосуд из изолирующего стекла, к нижней части которого припаян шарик из специального электродного стекла. Такой электрод снабжен токоотводом. В качестве внутреннего стандартного раствора в стеклянном электроде используют 0,1 М раствор хлористоводородной кислоты обычно с добавкой хлорида натрия и калия. Можно использовать также какой-либо буферный раствор с добавкой хлоридов или бромидов. Токоотводом служит хлорсеребряный электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра. К токоотводу припаивают изолированный, экранированный провод. Стеклянный электрод обычно используют в паре с хлорсеребряным электродом сравнения. Применяемую при этом электрохимическую цепь можно записать следующим образом
Стеклянный электрод – это несколько условное название несложной системы, включающей небольшой сосуд из изолирующего стекла, к нижней части которого припаян шарик из специального электродного стекла. Такой электрод снабжен токоотводом. В качестве внутреннего стандартного раствора в стеклянном электроде используют 0,1 М раствор хлористоводородной кислоты обычно с добавкой хлорида натрия и калия. Можно использовать также какой-либо буферный раствор с добавкой хлоридов или бромидов. Токоотводом служит хлорсеребряный электрод, представляющий собой серебряную проволоку, покрытую хлоридом серебра. К токоотводу припаивают изолированный, экранированный провод. Стеклянный электрод обычно используют в паре с хлорсеребряным электродом сравнения. Применяемую при этом электрохимическую цепь можно записать следующим образом
Ag, AgCl|HCl(0,1M) || стекло|| исследуемый р-р|| KClнас| AgCl, Ag
 2015-07-14
2015-07-14 5160
5160
