Метод известен с 90-х гг. XIX в., однако признан как аналитический метод анализа только в 20-х гг. XX в. Потенциометрический метод, основанный на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико–химических величин.
В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения. Величину ЭДС можно рассчитать по разности потенциалов этих электродов. Зависимость величины электродного потенциала (ЭП) от активности ионов в растворе выражается уравнением Нернста
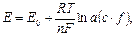 (26)
(26)
где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная (R = 8,314 Дж/моль⋅К); Т – абсолютная температура; n – число электронов (е), участвующих в реакции; c – концентрация, моль/дм3; f – коэффициент активности.
Так как в потенциометрии используются разбавленные растворы, где f = 1, то активность (а) заменяют на концентрацию (с). Если перейти от ln к lg, то при T = 298 K (25 °С) уравнение (26) запишется так:
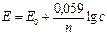 . (27)
. (27)
 2015-07-14
2015-07-14 2145
2145








