Различают два вида потенциометрических измерений:
1. Прямая потенциометрия – определение концентрации ионов, в частности [H+], с помощью уравнения Нернста по ЭДС гальванического элемента. Самое известное приложение этого вида потенциометрии – рН-метрия.
2. Потенциометрическое титрование основано на использовании измерений ЭП для нахождения точки эквивалентности в различных реакциях.
Аппаратура для проведения прямой потенциометрии и потенциометрического титрования одна и та же. В схему потенциометрических измерений входят индикаторный электрод, электрод сравнения и потенциало-измеряющий прибор. В качестве последних используют различные рН-метры. Перед измерением рН проводят настройку приборов по буферным растворам.
При потенциометрическом титровании могут быть использованы следующие типы химических реакций, в ходе которых изменяется концентрация потенциалопределяющих ионов: реакции кислотно-основного взаимодействия, реакции окисления-восстановления, реакции осаждения и комплексообразования.
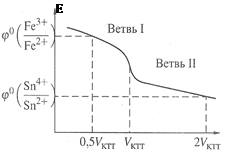
Пример: титрование раствора FeCl3 раствором SnCl2.
Пусть требуется определить в растворе концентрацию соли FeСl3. Составим гальванический элемент (рис.20): один электрод водородный, другой – редокс-электрод с изучаемым раствором FeCl3.
|
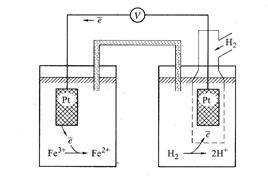 В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счёт окисления Н2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ пары ещё нет, так как имеется только один её компонент – ионы Fe3+.
В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счёт окисления Н2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ пары ещё нет, так как имеется только один её компонент – ионы Fe3+. Начнём добавлять к раствору FeСl3 в данном полуэлементе раствор соли SnCl2. Будет происходить реакция:
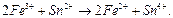
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/ Fe2+, и измеряемая ЭДС будет определяться соотношением её компонентов:
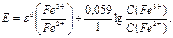 (29)
(29)
По мере добавления SnCl2 отношение 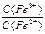 и, следовательно ЭДС будет снижаться (ветвь I на рис.21). В критической точке титрования будет оттитровано всё количество Fe3+, так что в растворе останутся только продукты реакции – ионы Fe2+ и Sn4+, т.е., ОВ пары в растворе вновь больше нет. При дальнейшем добавлении раствора SnCl2, в системе возникнет новая ОВ пара – Sn4+/ Sn2+, и теперь ЭДС определяется ею
и, следовательно ЭДС будет снижаться (ветвь I на рис.21). В критической точке титрования будет оттитровано всё количество Fe3+, так что в растворе останутся только продукты реакции – ионы Fe2+ и Sn4+, т.е., ОВ пары в растворе вновь больше нет. При дальнейшем добавлении раствора SnCl2, в системе возникнет новая ОВ пара – Sn4+/ Sn2+, и теперь ЭДС определяется ею
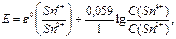 (30)
(30)
– ветвь II на рисунке.
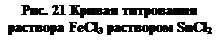 По мере добавления SnCl2 соотношение
По мере добавления SnCl2 соотношение 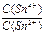 тоже падает, так что Е продолжает снижаться. Но критический объём титрования легко определить по точке перегиба кривой – когда происходит переход от ветви I к ветви II. Кроме того, как видно, можно найти также стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
тоже падает, так что Е продолжает снижаться. Но критический объём титрования легко определить по точке перегиба кривой – когда происходит переход от ветви I к ветви II. Кроме того, как видно, можно найти также стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
при 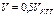
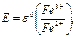 при
при 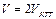
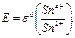 (31а, б)
(31а, б)
Главное преимущество потенциометрического метода по сравнению с другими методами анализа – быстрота и простота проведения измерений. Время установления равновесного потенциала индикаторных электродов мало, что удобно для изучения кинетики реакций и автоматического контроля технологических процессов. Используя микроэлектроды, можно проводить определения в пробах объемом до десятых долей, см3. Потенциометрический метод дает возможность проводить определения в мутных и окрашенных растворах, вязких пастах, при этом исключая операции фильтрации и перегонки. Потенциометрические измерения относят к группе неразрушающих способов контроля, и анализируемый раствор может быть использован для дальнейших исследований. Погрешность определения при прямом потенциометрическом измерении составляет 2 – 10 %, при проведении потенциометрического титрования – 0,5 – 1,0 %. Интервал определения содержания компонентов потенциометрическим методом в различных природных и промышленных объектах – в пределах от 0 до 14 рН для стеклянных электродов, и от 10 до 10–5 (10–7) М определяемого иона для других типов ионоселективных электродов. Одним из достоинств метода потенциометрического титрования является возможность полной или частичной его автоматизации. Автоматизировать можно подачу титранта, запись кривой титрования, отключение подачи титранта в заданный момент титрования, соответствующий точке эквивалентности.
2.1.4. Техника потенциометрического титрования
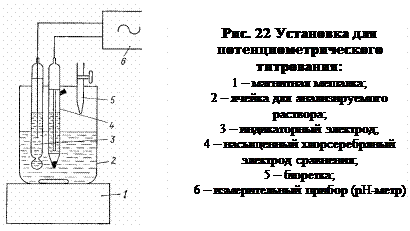
Схема установки для потенциометрического титрования с индикаторным электродом и электродом сравнения приведена на рисунке22.
В ходе титрования измеряют и записывают ЭДС ячейки после добавления каждой порции титранта. В начале титрант добавляют небольшими порциями, при приближении к конечной точке (резкое изменение потенциала при добавлении небольшой порции реагента) порции уменьшают. Следует помнить, что при приливании титранта недопустимо его прямое попадание на электрод и стенки стакана!
 | |||
 | |||
|
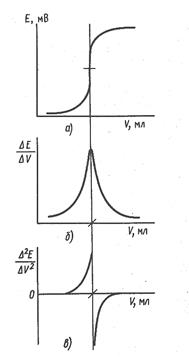
Для определения конечной точки потенциометрического титрования можно прибегнуть к графическим методам. На рисунке 23 кривая титрования представлена в интегральной форме (график зависимости потенциала электрода от объема титранта) (а), в форме первой (б) и второй (в) производной.
Из рисунка видно, что наиболее точно конечную точку титрования можно определить, используя метод первой и второй производной. Рассмотренные способы основаны на предположении, что кривая титрования симметрична относительно точки эквивалентности и перегиб кривой соответствует этой точке. Это допущение справедливо при условии, что вещества взаимодействуют в эквимолекулярных соотношениях и что электродный процесс полностью обратим.
 2015-07-14
2015-07-14 6655
6655








