Моделювання процесів електрохімічної корозії
На практиці електрохімічна корозія виникає при умові контакту металу з розчинами електролітів, тобто середовищ, які є іонними провідниками електричного струму, наприклад водні розчини солей або кислот. При цьому виникає ЕРС (електрорушійна сила), яка прямо пропорційно залежить від величини стандартного електродного потенціалу металу. Величини стандартних електродних потенціалів деяких металів наведені в табл. 23.
Таблиця 23 - Величини стандартних електродних потенціалів
| Реакція | Величина потенціалу Ео, В |
Al3+ + 3 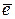 ↔ Al ↔ Al
| - 1,65 |
Zn2+ + 2 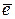 ↔ Zn ↔ Zn
| - 0,65 |
Fe2+ + 2 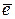 ↔ Fe ↔ Fe
| - 0,44 |
Cu2+ + 2 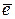 ↔ Cu ↔ Cu
| + 0,34 |
Для моделювання такого процесу використовують декілька середовищ:
- водяний розчин соляної кислоти (рН = 4-5);
- водяний розчин хлористого натрію (рН = 8-9).
В якості об’єкта корозії вибрані наступні металеві зразки із сталі (Ст-3 та Ст-20Х), міді, алюмінію та цинку.
Зразки з’єднують парами за допомогою дротів:
- 1 пара: Ст-3 - Ст-20Х;
- 2 пара: Ст-3 - мідь;
- 3 пара: Ст-3 - алюміній;
- 4 пара: Ст-3 - цинк.
Виводи дротів підключають до гальванометра. Потім послідовно занурюють пари металів до приготовлених розчинів і заміряють величину ЕРС. Схема експерименту наведена на рис. 4.
Дані, отримані при випробуваннях, необхідно занести в табл. 24.
Таблиця 24- Експериментальні дані, отримані в лабораторній роботі 3
| № п/п | Пари металів | Показник гальванометра | |
| у розчині НСІ | у розчині NaСІ | ||
| Ст-3 - Ст-20Х | |||
| Ст-3 - Cu | |||
| Ст-3 - Al | |||
| Ст-3 - Zn |
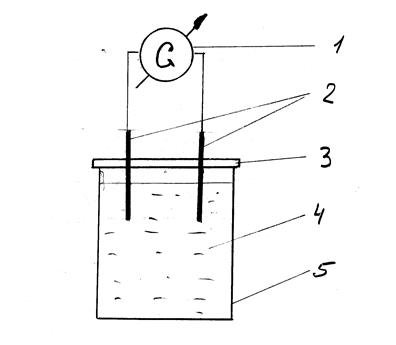
Рис. 4 - Схема моделювання електрохімічної корозії металів: 1 – гальванометр; 2- зразки металів; 3 – ізолююча кришка; 4 - розчин електроліту;
5 – лабораторний стакан.
 2015-07-14
2015-07-14 249
249








