2H3PO4 + Ca(OH)2 Þ Ca(H2PO4)2 + 2H2O
H3PO4 + Ca(OH)2 Þ CaHPO4 + 2H2O
H2SO4 + NaOH Þ NaHSO4 + H2O
При написании эмпирических формул кислых солей необходимо учитывать, что в анионе соли каждый атом водорода уменьшает заряд кислотного остатка на одну единицу. Применительно к серной кислоте H2SO4, кислые соли которой содержат ион HSO4–, формулы будут иметь следующий вид:
для однозарядных катионов – NaHSO4, KHSO4;
для двухзарядных катионов – Mg(HSO4)2, Zn(HSO4)2;
для трёхзарядных катионов – Al(HSO4)3, Fe(HSO4)3.
В графических формулах этих солей частично сохраняется структура кислоты, например:
CaHPO4 Ca(H2PO4)2
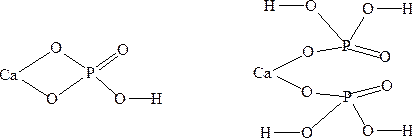
Кислую соль можно получить не только реакцией кислоты с основанием, но и из средней соли:
Ca3(PO4)2 + H3PO4 Þ 3CaHPO4
Ca3(PO4)2 + 4H3PO4 Þ 3Ca(H2PO4)2.
Чтобы перевести кислую соль в среднюю, нужно к кислой соли добавить основание:
2CaHPO4 + Ca(OH)2 Þ Ca3(PO4)2 + 2H2O.
Основные соли
Основные соли – продукты неполного замещения ОН–-ионов основания на ионы кислотного остатка. Основные соли образуются при нейтрализации из многокислотных оснований.
 2015-07-14
2015-07-14 809
809








