КОМИ ФИЛИАЛ
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов 1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
к практическому (лабораторному) занятию
по дисциплине Химия
ТЕМА: Комплексные соединения (КС).
ЦЕЛЬ: Закрепить теоретические знания по структуре КС, природе химической связи в них и их диссоциации. Изучить значение КС в химии и медицине.
ЗАДАЧИ: Изучить равновесие в растворах комплексных соединений, использовать значение Кнест комплексного иона для решения расчетных задач.
СРЕДСТВА ОБУЧЕНИЯ: Варианты тестовых заданий. Набор химической посуды и реактивов.
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. до изучения темы: Строение и свойства d, f-элементов, механизм реакции ионного обмена, диссоциацию электролитов.
2. после изучения темы: Номенклатура и изомерия КС, диссоциация и константа нестойкости. Образование и разрушение координационных соединений. Использование комплексообразования для медицины.
СТУДЕНТ ДОЛЖЕН УМЕТЬ:
Определять КС, называть, записывать уравнения диссоциации КС и выражение для Кнест. Производить расчеты концентрации иона-комплексообразователя в КС, использовать закон эквивалентов для определения содержания ионов некоторых металлов по комплексонометрии.
СОДЕРЖАНИЕ ЗАНЯТИЯ:
Вводный контроль.
Тестирование по теме занятия. Примерный перечень тестовых заданий:
1. Комплексные соединения - это
1) сложные устойчивые химические образования
2) вещества, состоящие из комплексообразователя и лигандов
3) соединения, состоящие из внутренней и внешней сферы
4) сложные устойчивые химические соединения, в которых присутствует хотя бы одна донорно-акцепторная связь
2. Комплексообразователи – это
1) только атомы, доноры электронных пар
2) только ионы, акцепторы электронных пар
3) только d-элементы, доноры электронных пар
4) атомы или ионы, акцепторы электронных пар
3. Наименьшей комплексообразующей способностью обладают
1) d-элементы 2) s-элементы 3) p-элементы 4) f-элементы
4. Лучшим комплексообразователем из Na, Mg, Co, Al является
1) Na 2) Mg 3) Co 4) Al
5. Назовите комплексообразователь в гемоглобине
1) Cu0 2) Fe3+ 3) Fe2+ 4) Fe0
6. Координационное число комплексообразователя равно
1) степени окисления комплексообразователя 2) числу монодентатных лигандов
3) половине степени окисления комплексообразователя 4) числу бидентатных лигандов
7. Лиганды – это
1) молекулы - доноры электронных пар
2) ионы - акцепторы электронных пар
3) молекулы и ионы - доноры электронных пар
4) молекулы и ионы - акцепторы электронных пар
8. При образовании комплекса лиганды являются
1) донором электронной пары 2) акцептором электронной пары
3) и донором, и акцептором электронной пары
4) ковалентная связь в комплексе образуется по ионному механизму
9. Связь между комплексообразователем и лигандом
1) ковалентная по донорно-акцепторному механизму
2) ковалентная по обменному механизму
3) ионная
4) металлическая
10. Дентатность лиганда равна
1) координационному числу комплексообразователя
2) степени окисления комплексообразователя
3) числу координационных мест, занимаемых данным лигандом
4) удвоенной степени окисления комплексообразователя
11. Дентантность – это
1) число связей между комплексообразователем и лигандом
2) число электронодонорных атомов в лиганде
3) число электронодонорных атомов в комплексообразователе
4) число электроноакцепторных атомов в лиганде
12. В хелатные соединения входят
1) монодентатные лиганды 2) полидентатные лиганды
3) бидентатные лиганды 4) би- и полидентатные лиганды
13. По дентатности этилендиаминтетраацетат является лигандом
1) монодентатным 2) бидентатным 3) полидентатным 4) тетрадентатным
14. Дентатность лиганда ОН-
1) моно- 2) би- 3) поли- 4) тетра
15. Монодентатными лигандами из перечисленных а) CN- б) OH- в) CO32- г) C2O42- д) NO2- являются
1) а, б, д 2) а, б, в 3) в, г, д 4) б, г, д
16. Бидентатным является лиганд
1) CO32- 2) OH- 3) H2O 4) NH3
17. Гемоглобин (Hb) по химической природе представляет собой
1) Hb - сложный белок, содержащий хелатный макроцикл гем с Fe+2
2) Hb - кислый белок, содержащий небелковую часть - гем с железом в степени окисления +3
3) Hb - транспортная форма кислорода, содержащая атом железа в нейтральном состоянии
4) Hb - резервная форма кислорода, содержащая атом железа в степени окисоения+2
18. В биокомплексах координация лигандов идет, как правило, через атомы элементов
1) O, N 2) O, N, S 3) H, O, P 4) H, P, S
19. Координационное число – это
1) число связей комплексообразователя 2) число центральных атомов
3) число лигандов 4) заряд внутренней сферы
20. Координационное число иона кобальта в соединении К3[Co(CNS)6] равно
1) 6 2) 3 3) 4 4) 2
21. Координационная формула соли состава CoCl3 ∙ 5NH3
1) [Co(NH3)5]Cl3 2) [Co(NH3)5Cl2]Cl 3) [Co(NH3)5Cl3] 4) [Co(NH3)5Cl]Cl2
22. Координационное число иона кобальта в соединении [Co(NH3)5Cl]Cl2 равно
1) 3 2) 5 3) 4 4) 6
23. Название соединения [Co(NH3)5NO2]Br2
1) бромонитропентаамминкобальта (III) 2) бромид пентаамминнитрокобальта (III)
3) пентаамминнитробромид кобальта (III) 4) пентаамминнитрозобромид кобальта (III)
24. Название соединения K4[Co(CNS)6]
1) гексароданокобальтат (II) калия 2) гексацианокобальтат (II) калия
3) гексароданокобальтат (IV) калия 4) гексароданокобальтат (III) калия
25. Название соединения [Pt(NH3)2Cl2]
1) хлорид диамминоплатины (II) 2) хлородиамминоплатины (II)
3) дихлородиамминоплатины (II) 4) дихлорид диамминоплатины (II)
26. Координационная формула соединения хлорида хлоропентаамминокобальта(III)
1) [Co(NH3)5Cl]Cl2 2) [Co(NH3)5]Cl3 3) [Co(NH3)5Cl2]Cl 4) [Co(NH3)5Cl3]
27. Координационная формула соединения дибромодихлородиаквакобальтата (III) калия
1) K2[Co(H2O)2Br2Cl2] 2)K[Co(H2O)2Br2Cl2]3) K3[Co(H2O)2Br2Cl2] 4) K[Co(H2O)4Br2Cl2]
28. Координационная формула соединения дибромодийодомеркурата (II) аммония
1) (NH4)2[HgBr2I2] 2) (NH4)2[HgBr2I] 3) (NH4)2[HgBrI2] 4) (NH4)[HgBr2I2]
29. Координационная формула комплексного соединения общей формулой CoCl3 ∙ 5NH3, при действии на которое нитратом серебра осаждается 2/3 содержащегося в нем хлора
1) [Co(NH3)5Cl]Cl2 2) [Co(NH3)5]Cl3 3) [Co(NH3)5Cl2]Cl 4) [Co(NH3)5Cl3]
30. Название соединения
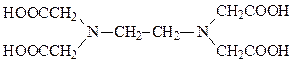
1) нитрилотриуксусная кислота
2) пропилендиаминтетрауксусная кислота
3) этилендиаминтетрауксусная кислота
4) нитрилотрифосфоновая кислота
31. Константа нестойкости комплексного иона [Ag(NH3)2]+ рассчитывается по формуле
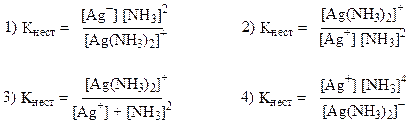
32. Константа нестойкости комплексного иона [Fe(CN)6]3- рассчитывается по формуле
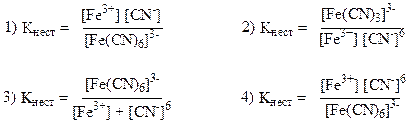
33. Ион, входящий в состав гема
1) Fe2+ 2) Co3+ 3) Mo2+ 4) Mn2+
34. Количество связей иона Fe2+ c порфириновым циклом при образовании гема
1) 2 2) 5 3) 4 4) 6
35. Ион Fe2+ гемоглобина наиболее прочную связь образует с
1) кислородом 2) угарным газом 3) углекислым газом 4) водой
36. Ион, входящий в состав цианкобаламина
1) Fe3+ 2) Mo2+ 3) Co3+ 4) Mn2+
37. Терапевтическим действием при онкологических заболеваниях обладает
1) транс - дихлородиамминоплатина (II) 2) цис - дихлородиамминоплатина (II)
3) тетрахлороплатинат (II) калия 4) цис - трихлороамминоплатина (II)
38. Соединением, применяющимся в хелатотерапии, является
1) ДДТ 2) ЭДТФ 3) ЭДТА 4) НТФ
39. Чем меньше Кнест, тем комплекс более
1) устойчивый 2) неустойчивый 3) растворимый 4) устойчивость не определяется Кнест
40. Устойчивость комплекса с увеличением числа донорных атомов в полидентатном лиганде
1) увеличивается 2) уменьшается 3) не изменяется
4) может и увеличиваться, и уменьшаться
41. Наиболее прочным является комплекс
1) Кнест [Zn(OH)4]2- = 1.99*10-18 2) Кнест [Zn(CN)4]2- = 2.40*10-20
3) Кнест [Zn(NH3)4]2+ = 8.30*10-12 4) Кнест [Zn(H2O)4]2+ = 2.10*10-10
42. Расположите соединения по увеличению прочности, если: а) Кнест [Zn(NH3)4]2+ = 8.3*10-12
б) Кнест [Ni(NH3)4]2+ = 3.4*10-8 в) Кнест [Cd(NH3)4]2+ = 2.8*10-7 г) Кнест [Cu(NH3)4]2+ = 1.1*10-12
1) а, б, в, г 2) б, г, в, а 3) в, б, а, г 4) в, г, б, а
43. Расположите соединения по уменьшению прочности, если: а) Кнест [Fe(CN)6]3- = 1.3*10-44
б) Кнест [Fe(CN)6]4- = 1,3*10-27 в) Кнест [Co(CN)6]4- = 8.1*10-20 г) Кнест [Co(CN)6]3- = 1.0*10-64
1) а, г, б, в 2) г, а, б, в 3) б, г, в, а 4) а, б, г, в
44. Разрушить комплекс [Ag(NH3)2]Cl можно, если: а) добавить HNO3; б) добавить NaOH; в) добавить NaCl; г) добавить KI
1) а, г 2) а, б 3) б, в 4) в, г
45. Чему равна степень окисления центрального атома в молекуле K3[Fe(CN)6]
1) +3 2) +4 3) +2 4) 0
46. Определите заряд внутренней сферы в соединении K4[Fe(CN)6]
1) +4 2) -4 3) -3 4) -2
47. Не имеет первичной диссоциации комплекс
1) K2[PtCl6] 2) [Co(NH3)6]Cl3 3) [Pt(NH3)2Cl2] 4) [Ag(NH3)2]OH
48. Комплексообразователем в хлорофилле является
1) Co 2) Fe 3) Mg 4) Mn
49. Комплексообразователем в молекуле витамина В12 является
1) Fe 2) Co 3) Ni 4) Mg
50. Заряд внутренней сферы и комплексообразователя в соединении K4[FeF6] равны соответственно
1) -4, +3 2) -4, +2 3) +3, -2 4) -2, +6
 2015-07-14
2015-07-14 3727
3727








