1) Выполнить лабораторную работу «Получение комплексных соединений и изучение их устойчивости. Определение общей жесткости воды».
2) Цель работы: Получить КС, изучить условия их разрушения. Сравнить устойчивость КС в растворе с устойчивостью средних и двойных солей. Определить общую жесткость водопроводной и минеральной воды.
3) Методика проведения работы.
Опыт 1. Получение комплексного соединения никеля и его разрушение.
а) К 1 мл раствора сульфата никеля (II) в пробирке добавьте по каплям концентрированный раствор аммиака. Наблюдайте выпадение осадка основной соли (NiOH)2SO4. Добавьте к нему избыток аммиака. Что наблюдается? Изобразите схему происходящих превращений, учитывая, что в аммиачном комплексе координационное число иона Ni+2 равно шести. Укажите изменение окраски.
б) Добавьте к полученному раствору по каплям раствор серной кислоты. Как изменяется окраска раствора?
Напишите уравнение реакции в ионном виде и объясните причину разрушения аммиачного комплекса Ni(II) под действием кислоты, используя для этого значения Кнест.
Опыт 2. Получение комплексного соединения цинка и его разрушение.
В пробирку налейте 1 мл сульфата цинка и добавьте к нему по каплям раствор гидроксида натрия до появления осадка гидроксида цинка. К раствору с осадком добавьте избыток щелочи, постоянно встряхивая содержимое пробирки до полного растворения осадка. К полученному раствору КС добавьте 3-4 капли раствора серной кислоты. Отметьте появление осадка в виде помутнения раствора.
Напишите уравнение реакции образования КС, учитывая, что к.ч. (Zn+2) = 4. Объясните причину разрушения гидроксокомплекса при добавлении кислоты и напишите уравнение реакции в ионном виде.
Опыт 3. Отличие комплексных солей от простых (средних) и двойных солей, содержащих Fe (III).
Двойными солями называют соли с разными катионами типа KAl(SO4)2. Их сульфаты называют квасцами (алюмокалиевые квасцы). Двойные соли можно рассматривать как КС с малоустойчивой внутренней сферой: K[Al(SO4)2].
В три пробирки поместите по 1 мл раствора солей, содержащих Fe (III):
1. FeCl3 – хлорид железа (III), средняя соль;
2. (NH4)2SO4 • Fe2(SO4)3 – железоаммониевые квасцы (соль Мора), двойная соль;
3. K3[Fe(CN)6] – гексацианоферрат (III) калия, комплексная соль.
В каждую пробирку добавьте по несколько капель раствора роданида калия (или аммония). Ион SCN- служит для обнаружения ионов Fe+3 в растворе, т.к. образует с ним роданид железа (III), Fe(SCN)3, кроваво-красного цвета.
Приведите уравнение диссоциации солей и выражение Кнест для КС.
Опыт 4. Определение общей жесткости воды.
1. Отбирают аликвоту анализируемой воды (анализируемого раствора) добавляют 5-10 мл аммиачного буферного раствора с рН 9-10 и вносят на кончике шпателя индикатор ЭХЧ-Т. Тщательно перемешивают. Раствор приобретает винно-красное окрашивание, характерное для комплексного соединения индикатора с ионами Са2+ и Mg2+:
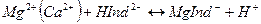
2. Бюретку, предварительно вымытую и промытую стандартным раствором трилона Б, заполняют до нулевой отметки стандартным раствором трилона Б, проверяя и устраняя возможное наличие воздуха в носике бюретки.
3. Титруют анализируемый раствор, приготовленный согл. п.1 до изменения окраски из винно-красной до сине-серой. Титрование проводят трижды, и полученные результаты заносят в таблицу.
4) Результаты опыта 4 представить в виде заполненной таблицы:
Комплексонометрическое определение жесткости воды
С(1/2 Трилон Б) = 0,05N, индикатор - ЭХЧ-Т, аммиачный буферный раствор (рН 9-10).
| Исследуемый объект | Vал, мл | Vбюр, мл | Ж, моль/л | Ж (теор), моль/л (паспорт воды) |
| Водопроводная вода | 100,0 100,0 100,0 | |||
| Минеральная вода | 20,0 20,0 20,0 |
5) В выводе отразить итог проделанной работы: - Какие условия необходимы для получения изученных КС и для их разрушения. Дать характеристику по жесткости исследуемой воды.
4. Задачи для самостоятельного разбора на занятии:
1. Для следующих комплексных соединений: Na3[Al(OH)6] K2[PtCl4] Na3[Co(NO2)6]
[Al(NH3)6]Cl3 [Cr(H2O)6]CI3 [Ni(CO)4]SO4 [Fe(CO)5] [Co(H2O)2CI2] [PtCl2(NH3)2]
Определите: а) заряд внутренней сферы и тип комплекса; б) центральный атом и его степень окисления; в) координационное число центрального атома; г) лиганды, их заряд; д) ионы внешней сферы, их количество и заряд; е) запишите уравнения диссоциации и выражение для Кнест.
2. Напишите уравнение реакции получения аммиачных комплексов для ионов Сu2+и Fe2+.
3. Дайте полную характеристику каждому из приведенных комплексных соединений, назовите их: [Zn(NH3)4]Cl2; [Cr(en)2Cl2]+; K2[FeCl4]; Na3[Cr(C2O4)3]; [Pt(NH3)4Cl2]Cl2; [Cr(NH3)4Br2]Br; [AuCl4]-; [Cr(C2O4)Br4]3-.
4. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Ag(NH3)2]+ и [Ag(CN)2]-, если Kнест ионов соответственно равны 7.0·10-8 и 1.0·10-21. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
5. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Ag(NO2)2]- и [Ag(NH3)2]+, если Kнест ионов соответственно равны 1.3·10-3 и 6.8·10-8. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
6. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Ag(CN)2]- и [Ag(NO2)2]-, если Kнест ионов соответственно равны 1.0·10-21 и 1.3·10-3. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
7. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [CdCl6]4- и [Cd(NH3)6]2+, если Kнест ионов соответственно равны 2.0·10-3 и 1.0·10-6. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
8. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [CdI6]4- и [CdCl6]4-, если Kнест ионов соответственно равны 1.0·10-6 и 2.0·10-3. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
9. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Cd(CN)4]2- и [Cd(NH3)4]2+, если Kнест ионов соответственно равны 8.0·10-18 и 8.0·10-8. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
10. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Сu(ОН)4]2- и [Cu(NH3)4]2+, если Kнест ионов соответственно равны 2.0·10-3 и 2.0·10-13. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
11. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Fe(CN)6]4- и [Fe(CN)6]3-, если Kнест ионов соответственно равны 1.0·10-24 и 1.0·10-31. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
12. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [HgCl4]2- и [HgI4]2-, если Kнест ионов соответственно равны 1.0·10-16 и 1.0·10-30. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
13. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [HgI4]2- и [Hg(NH3)4]2+, если Kнест ионов соответственно равны 1.0·10-30 и 1.0·10-18. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
14. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [PtBr4]2- и [PtI4]2-, если Kнест ионов соответственно равны 1.0·10-21 и 1.0·10-30. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
15. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах комплексных ионов [Zn(OH)4]2- и [Zn(NH3)4]2+, если Kнест ионов соответственно равны 1.0·10-8 и 1.0·10-16. Напишите уравнение диссоциации первого комплексного иона и выражение Kнест для него.
16. Сравните концентрации ионов-комплексообразователей в 0.1 М растворах солей К[А1(ОН)4(Н2О)2] и К[Сг(ОН)4(Н2О)2], если рKнест[А1(ОН)4(Н2О)2]- = 33; pKнест[Сr(ОН)4(Н2О)2]- = 30. Как изменятся эти концентрации при добавлении к растворам: a) NaOH; б) НСl?
17. Сколько граммов трилона Б требуется для приготовления 250 мл 0,05 н раствора, если эквивалент трилона Б равен половине его молекулярной массы?
18. На титрование 25 мл 0,1 н раствора MgCl2 ушло 24,9 мл трилона Б. Рассчитать нормальность и титр раствора трилона Б.
19. При титровании 20 мл раствора Mg2+ c эрихромом черным Т ушло 10,15 мл 0,1 н раствора трилона Б. Сколько миллиграммов Mg2+ содержится в 100 мл этого раствора?
20. Для титрования 25 мл стандартного раствора 0,02 н карбоната кальция требуется 20 мл раствора ЭДТА. При определении жесткости воды на титрование 75 мл жесткой воды пошло 30 мл того же раствора ЭДТА. Рассчитать количество кальция и карбоната кальция (в мг/л) в исследуемой воде.
21. Рассчитать нормальную концентрацию Mg2+ в воде, если при титровании 100 мл воды трилоном Б при рН = 10 в присутствии эрихрома черного Т пошло 19,2 мл 0,1012 н раствора трилона Б.
22. Вычислить количество Al3+ в растворе по следующим данным: к раствору добавили 15 мл 0,11 н раствора трилона Б, избыток оттитровали 3 мл 0,101 н раствора ZnSO4.
Основная:
1. В.А. Попков, С.А. Пузаков. Общая химия: Учебник. - М.: ГЭОТАР-Медиа. - 2010.
2. С.А. Пузаков, В.А. Попков. Сборник задач и упражнений по общей химии. - М.: Высшая школа. – 2004.
Дополнительная:
1. В.И. Слесарев. Основы химии живого.- Санкт-Петербург: Химиздат.- 2001.
2. А.В. Суворов, А.Б. Никольский. Вопросы и задачи по общей химии. – Санкт-Петербург: Химиздат. – 2002.
Методические указания подготовлены: доцентами Н.И. Никитиной и Е.И. Казаковой
Методические указания утверждены на заседании кафедры №_____ от «___» ________20___ г.
Зав. кафедрой: _____________________________/Е.И. Казакова
 2015-07-14
2015-07-14 1649
1649








