1. Выбрать наиболее прочное комплексное соединение из соединений Fe2+ с биолигандами: глицерином (1), гистидином (2), лизином (3).
Решение: прочность комплекса характеризуется Кнест: чем меньше Кнест, тем более прочный комплекс. Из справочника: Кнест(1) = 1,58·10-8 Кнест(2) = 5,01·10-10 Кнест(3) = 3,16·10-5
Ответ: наиболее прочное комплексное соединение Fe2+ c гистидином, т.к. Кнест(2)‹Кнест(1)‹Кнест(3).
2. Вычислить концентрацию ионов Аg+ в 0,1 М растворе [Ag(NH3)2]+, если Кнест=1∙10-8.
Решение: если обозначить концентрацию ионов Ag+ через х, то раствор будет характеризоваться следующими равновесными концентрациями (моль/л):
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
0,1-х х 2х
Так как диссоциация комплексного иона невелика, то разность 0,1-х можно принять равной 0,1.
Тогда Кнест = 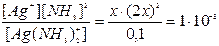 , Отсюда 4х3 = 10-9,
, Отсюда 4х3 = 10-9, 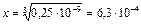 .
.
Ответ: [Ag+] в растворе аммиаката серебра составляет 6,3 ∙ 10-4 моль/л.
3. Вычислить концентрацию ионов Zn2+ в растворе Na2[Zn(CN)4] с концентрацией 0,3 моль/л при избытке цианид-ионов, равном 0,01 моль/л.
Решение: вторичная диссоциация комплексного иона протекает по уравнению:
[Zn(CN)4]2- ↔ Zn2+ + 4CN-
Кнест = 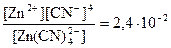 (справочная величина)
(справочная величина)
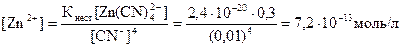
Ответ: [Zn2+] в растворе тетрацианоцинката (II) натрия составляет 7,2·10-3 моль/л.
4. Возможно ли разрушение комплекса [Ag(NH3)2]+, концентрация которого в растворе составляет 0,1 моль/л, добавлением раствора КCl равного объема и равной концентрации. Увеличением объема пренебречь.
Решение: при добавлении KСl в растворе возможны два равновесных процесса:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
+
КСl → Cl- + K+
↕
AgCl↓ ПРAgCl = 1∙ 10-10.
Условием выпадения осадка АgCl и, следовательно, разрушения комплексного иона является соблюдение неравенства: ПИ > ПР, где ПИ = С(Ag+) ∙ С(Cl-);
С(Ag+) = 6,3 ∙ 10-4 моль/л см. предыдущую задачу,
С(Cl-) = С(КCl) = 0,1 моль/л, тогда ПИ = 6,3∙10-4∙0,1= 6,3 ∙ 10-5;
ПИ > ПР – осадок выпадает, комплекс в отсутствие избытка NH3 ионами Cl- разрушается.
Комплексонометрия – метод объемного анализа, в основе которого лежат реакции комплексообразования. В качестве рабочего раствора (титранта) используется раствор хелатообразующего лиганда – комплексона, который в присутствии аммиачной буферной смеси образует с катионами металлов комплексные соединения в анализируемом растворе. Самый распространенный комплексон, который используется в аналитической практике – комплексон III, динатриевая соль этилендиаминтетрауксусной кислоты (см. лекционный материал), раствор которого называют трилон Б. условное обозначение Na2H2Y.
Определение общей жесткости воды, обусловленное присутствием в ней ионов Са2+ и Mg2+, основано на реакции: H2Y2- + Me2+ (Ca2+,Mg2+) 1 MeY2- + 2H+
Структура комплексного соединения MeY2: 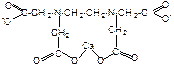
Очевидно, что образование хелата сопровождается обменной реакцией между двумя протонами двух карбоксильных групп на ион Ме2+. Следовательно число эквивалентности (Z) равно 2 для трилона Б и для иона металла. В присутствии аммиачной буферной смеси не происходит подкисление раствора выделяемыми протонами Н+.
Жесткость воды (Ж) выражается количеством миллимоль–эквивалентов ионов кальция и магния в литре исследуемого раствора:
Жесткость (Ж) 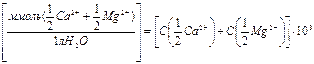
Санитарная норма – Ж < 7 ммоль/л; мягкая вода – Ж < 2 ммоль/л.
В точке эквивалентности выполняется закон эквивалентов: 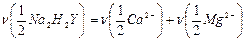 ;
;
с учетом концентрации стандартного раствора и его объема израсходованного на титрование:
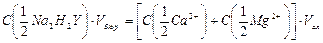 , откуда
, откуда 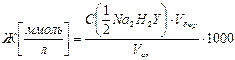
Титрование выполняют в присутствии аммонийного (аммиачного) буферного раствора. Точку конца титрования определяют с помощью металлоорганических индикаторов (металлохромных индикаторов), которые образуют с определяемыми катионами при тех же условиях окрашенные комплексные соединения, менее устойчивые, чем комплексы с титрантом трилоном Б.
В точке эквивалентности комплекс металла с индикатором разрушается, т.к. образуется более устойчивый комплекс катиона металла с трилоном Б, и индикатор выделяется в раствор, что приводит к резкому изменению окраски раствора: раствор приобретает окраску, обусловленную свободным индикатором.
При определении жесткости воды используют индикатор эриохром черный – Т (ЭХЧ-Т) – это сложная трехосновная органическая кислота, которая в зависимости от рН раствора образует по-разному окрашенные ионы:
H3Ind 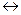 H2Ind-
H2Ind- 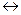 HInd2-
HInd2- 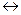 Ind3-
Ind3-
pH 6,3 6,3-11,2 >11,2
красный синий желтый
 2015-07-14
2015-07-14 6006
6006








