Очисні матеріали підрозділяються за видом основного технологічного ефекту, що супроводжує процес, на розчинні, емульгуючі і диспергуючі. Перші два види середовищ, які отримали найбільше поширення, використовуються в рідкому вигляді, а останній-в рідкому або твердому стані.
Основні явища, що обумовлюють очисну дію середовища, включають: розчинення, змочування, фізико-хімічну адсорбцію, емульгування, диспергування і стабілізацію забруднень.
Розчинення - це процес утворення однорідної системи з двох речовин з рівномірним розподіленням одної речовини в іншій. Найбільшою взаємною розчинністю характеризуються речовини з подібними будовою і властивостями - «подібне розчиняється в подібному».
Молекули води, спиртів, кислот, лугів і різних хімічних елементів полярні, тобто володіють дипольним моментом. У молекул деяких речовин дипольний момент може індукуватися (наводитись) при взаємодії з полярними молекулами. До таких речовин відносять, наприклад, вуглеводні з ароматичною основою.
Характер міжмолекулярної взаємодії визначає взаємну розчинність рідин. При введенні в розчинник розчинюваної речовини (рисунок 1.7) їх молекули вступають в електростатичну взаємодію, утворюючи агрегатовані молекули (сольвати). Останні рівномірно розподіляються по всьому об’єму розчинника. Розчинення супроводжується і дифузією як повільним проникненням молекул однієї речовини в проміжки між молекулами іншої речовини. Останній механізм розчинення притаманний неполярним рідинам. В цьому випадку в’язкість змішуваних речовин має основне значення.
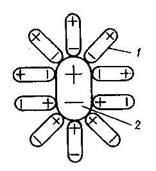 | Рисунок 1.7 - Модель агрегатованої молекули: 1- молекули розчинника, 2- молекули розчинюваної речовини |
Змочування полягає в розтіканні краплі рідини, розміщеної на поверхні твердого тіла. Ця властивість залежить від поверхневого натягу рідини, поєднання складу рідини і твердого тіла. Змочування - результат міжмолекулярної взаємодії середовищ на границі дотикання трьох фаз: тверде тіло – рідина - газ. Процес змочування дозволяє очисному розчину проникати в пори і тріщини твердого тіла. Вуглеводневі забруднення не змочуються водою, а мінеральні частинки зазвичай змочуються, але при відсутності жирових плівок на поверхні.
Сили в поверхневому шарі рідини намагаються надати їй таку форму, щоб її поверхня була найменшою. На кожну елементарну площадку біля краю рідини, що розтікається по поверхні твердого тіла (рисунок 1.8) діють сили Р1, Р2 і Р3 на границях відповідно тверде тіло-газ; тверде тіло-рідина, рідина-газ.
Рідина розтікається по поверхні при вдалому співвідношенні цих сил, що залежать від властивостей взаємодіючих речовин. Крайовий кут змочування φ визначається із співвідношення
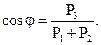 (1.1)
(1.1)
Чим менше значення кута φ, тим більша змочувальна здатність рідини.
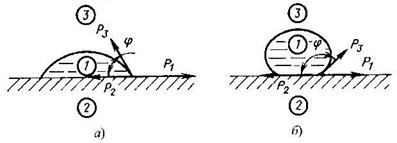 |
| Рисунок 1.8 - Схема взаємодії краплі рідини з поверхнею твердого тіла і газового середовища: а - змочування поверхні; б - поверхня не змочується; 1- крапля рідини; 2 - тверде тіло; 3 - газове середовище (повітря) |
На границі поверхні, що очищується і розчину існує приграничний шар молекул, не врівноважених рідким середовищем. Молекули шару перебувають під дією сил притягання молекул усього об’єму цієї рідини, тому шар володіє надлишком вільної енергії або адсорбційною активністю. Надлишок вільної енергії визначає поверхневу енергію або натяг. Поверхневий натяг вимірюють роботою, яку необхідно затратити на збільшення поверхні рідини на 1 см2, а добуток поверхневого натягу на величину поверхні називають вільною поверхневою енергією. Здатність речовини знижувати останню характеризує його поверхневу активність. Таким чином, речовини, що здатні знижувати поверхневий натяг розчину, називаються поверхнево-активними речовинами (ПАР).
ПАР являють собою полярні органічні сполуки. Популярність ПАР обумовлена будовою молекул, що складаються з гідрофобної і гідрофільної частин. Гідрофобна (водовідштовхуюча) частина молекули складається із залишку вуглеводневого ланцюга довжиною 10…18 вуглецевих атомів і сприяє розчиненню ПАР в оливі. Гідрофільна частина молекули містить карбоксильну СООН, гідроксильну ОН, сульфатну ОSO3 або аміногрупу NH2 і сприяє розчиненню ПАР у воді.
Адсорбція ПАР супроводжується утворенням адсорбційного і сольватного шарів молекул, що покривають всі поверхні. Процес адсорбції як збільшення концентрації розчиненої речовини біля поверхні забруднень зменшує щільність його з’єднання з металічною поверхнею і щільність самого забруднення, що призводить до утворення мікротріщин в забрудненні і його наступному руйнуванні (диспергуванні). В залежності від активності ПАР адсорбційні процеси супроводжуються різними ефектами: диспергуючими, розклинюючими, капілярними і їх комбінацією. Так, розклинюючий тиск в мікротріщинах досягає значень 80…100 МПа, а капілярні тиски – 150…260 МПа, що забезпечує руйнування твердих забруднень. Речовини, що здатні адсорбуватися на поверхні гідрофобних частинок, називаються емульгаторами.
Найбільшого поширення в очисних процесах набули колоїдні (милоподібні) ПАР. У водних розчинах колоїдні ПАР мають високу поверхневу активність, вони здатні утворювати колоїдні агрегати - міцели. Причиною міцелоутворення являється наявність в молекулах сильно полярної групи і гідрофобного радикала. Ця властивість проявляється при граничній концентрації ПАР. Утворення міцел при критичній концентрації міцелоутворення (ККМ) призводить до різкої зміни очисних властивостей розчинів ПАР, при цьому змінюється густина, електрична провідність, поверхневий натяг і миюча дія цих розчинів. Величина ККМ залежить від виду ПАР, наявності в розчині лужних добавок і температури розчину. Для різних ПАР значення ККМ складають 1…10 г/л.
Лужні добавки значно знижують ККМ, що забезпечує ефективну очисну дію розчину при меншій затраті ПАР.
Забруднення, як правило, складаються з рідкої (оливи, смоли) і твердої (пил, асфальтени, карбени і ін.) частин. Такі забруднення видаляють з поверхні виробу шляхом емульгування рідкої фази (утворення емульсій) і диспергування твердої фази (утворення дисперсій). На процеси емульгування і диспергування великий вплив має механічна дія розчину, що сприяє руйнуванню забруднень.
Суть стабілізації процесу очищення полягає у здатності очисного розчину утримувати в своєму об’ємі забруднення, перешкоджаючи зворотному осадженню їх на очищені поверхні деталі.
Процес очищення поверхні металу від забруднень в рідкому розчині ПАР можна представити багатьма діями (рисунок 1.9).
Вода, що володіє великим поверхневим натягом, не змочує гідрофобні забруднення, а стягується в окремі краплі. Розчинення у воді очисного засобу зменшує поверхневий натяг розчину, що призводить до проникнення його в тріщини і забруднення. Капілярна і розклинююча дії розчину призводять до руйнування забруднень. Частинки бруду, що відкололися переходять в розчин. Молекули ПАР адсорбуються на забрудненнях і очищеній поверхні і запобігають збільшенню частинок і осіданню їх на поверхні. В результаті частинки забруднень у зваженому стані стабілізуються в розчині і видаляються разом з ним.
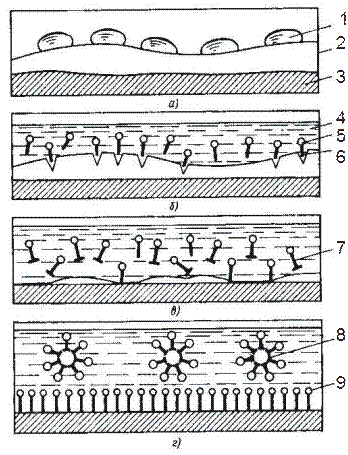 |
| Рисунок 1.9 - Схема очисного процесу в рідких технологічних середовищах: а-г - етапи процесу; 1 - каплі води; 2 - забруднення; 3 -поверхня, яка очищується; 4 - миючий розчин; 5 і 6 - відповідно гідрофільна і гідрофобна (радикал) частини молекули ПАР; 7 - переведення частинок забруднення у розчин; 8 - частинки забруднення, стабілізовані в розчині; 9 - адсорбовані молекули ПАР на очищеній поверхні |
 2015-07-14
2015-07-14 1259
1259








