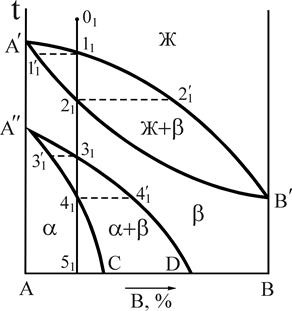
Компоненты этих сплавов неограниченно растворимы в жидком и твердом состояниях, не образуют химических соединений. В данном случае при затвердевании образуются однородные по структуре сплавы, состоящие из зерен - твердого раствора компонента В в А (или А в В). По этому типу диаграммы кристаллизуются сплавы Sb-Bi, Cu-Ni, Au-Ag, Fe-Ni и некоторые другие. Общий вид типовой диаграммы показан на рис.3.
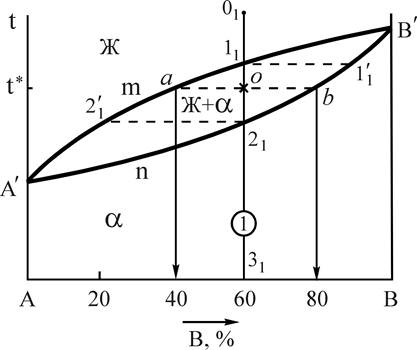 Рис.3. Диаграмма состояния системы А-В, с неограниченной растворимостью в твердом состоянии Рис.3. Диаграмма состояния системы А-В, с неограниченной растворимостью в твердом состоянии | Компоненты: А и В (К=2); фазы: Ж, a (твердый раствор) (Ф=2); линия А'nB' - линия солидус - геометрическое место точек критических температур конца процесса кристаллизации всех сплавов данной системы при охлаждении и начала плавления при нагреве; линия А'mB' - линия ликвидус, геометрическое место точек критических температур начала процесса кристаллизации всех сплавов данной системы при охлаждении и конца плавления при нагреве. |
По диаграмме этого типа кристаллизация всех сплавов протекает аналогично сплаву 1.
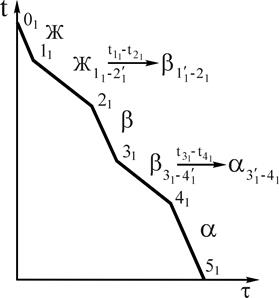
При кристаллизации сплава 1 (рис.4) от температуры 01 в нем происходят следующие превращения. До температуры точки 11, жидкий сплав охлаждается. При температуре точки 11, начинается процесс кристаллизации (зарождение центров кристаллизации). В интервале температур 11-21 кристаллизуется из жидкого сплава a-твердый раствор, состав которого изменяется по линии солидус на участке 1¢1-21, состав жидкой фазы изменяется по линии 11-2¢1 (см.рис.4). В соответствии с диаграммой состояния во всем интервале температур 11-21 образуются кристаллы a-твердого раствора, более богатые тугоплавким элементом В, чем исходный сплав 1. Это приводит к неоднородности химического состава в пределах одного зерна (дендрита), так называемой дендритной ликвации, которая при реальных условиях охлаждения сохраняется в твердых растворах.
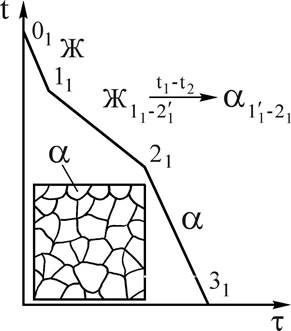 Рис.4. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре. Рис.4. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре. | Однако при очень медленном (равновесном) охлаждении состав сплава успевает выравниваться за счет диффузии и структура твердого раствора получается однородной (см. рис.4). В двухфазных областях и на линиях нонвариантных равновесий диаграмм двойных систем с помощью правила отрезков можно определить состав (концентрацию компонентов в фазах) и количественное соотношение фаз. Для того, чтобы определить концентрацию компонентов в фазах (их состав), через заданную точку, характеризующую состояние сплава, проводят горизонталь (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз. |
Определим составы фаз для сплава 1 при температуре t* (см. рис.3). Для этого, проводя при температуре t* горизонталь до пересечения с линиями, ограничивающими область А¢В¢А¢, получим точки пересечения " a " и " b ". Проекция точки " а " на ось концентрации определяет состав жидкой фазы - 40%В и 60%А. Проекция точки " b " показывает состав твердой фазы - 80%В и 20%А.
Для того чтобы определить количественное соотношение фаз по правилу отрезков, необходимо через заданную точку провести горизонталь до пересечения с ближайшими линиями диаграммы состояния. Отрезки этой линии между заданной точкой и точками пересечения, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например, относительное весовое количество твердой фазы для сплава 1 (см. рис.3) при температуре t*:
ОВКa = 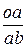 =
= 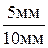 = 0,5 или 50 %.
= 0,5 или 50 %.
Относительное весовое количество жидкой фазы при температуре t*
ОВКЖ = 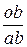 =
= 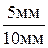 = 0,5 или 50 %.
= 0,5 или 50 %.
5.2.2. Диаграмма состояния сплавов с ограниченной взаимной растворимостью компонентов в твердом состоянии
В таких сплавах компоненты неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
Существуют два вида таких диаграмм: с эвтектическим и перитектическим превращением. Для сплавов Al-Si, Al-Cu и других характерна диаграмма с эвтектическим превращением, в результате которого по реакции 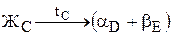 образуется микросмесь двух фаз (эвтектика). Эвтектика в переводе с греческого - легкоплавкий. Общий вид типовой диаграммы показан на рис.5.
образуется микросмесь двух фаз (эвтектика). Эвтектика в переводе с греческого - легкоплавкий. Общий вид типовой диаграммы показан на рис.5.
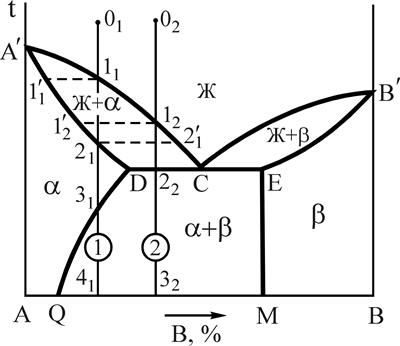 Рис.5. Диаграмма состояния системы А-B с эвтектическим превращением Рис.5. Диаграмма состояния системы А-B с эвтектическим превращением | Компоненты: А и В (К=2); фазы: Ж, a-твердый раствор, b-твердый раствор (Ф=3). Название a- и b-твердых растворов принимается условно, т.е. a-твердым раствором называем раствор компонента В в А, а b-твердый раствор - раствор компонента А в В. Линия А'СВ' - линия ликвидус, линия А'DЕВ' - линия солидус, линия DQ- линия предельной растворимости компонента B в А, линия ЕМ- предельной растворимости А в В, линия DСЕ - линия эвтектического превращения. |
Рассмотрим кристаллизацию двух сплавов 1 и 2. При охлаждении от точки 01 до температуры точки 11 происходит охлаждение жидкого сплава 1. При температуре точки 11 - образование центров кристаллизации в жидкой фазе. В интервале температур 11-21 - рост кристаллов a-твердого раствора из этих центров, при этом состав жидкой фазы изменяется по линии ликвидус, а твердой - по линии солидус. При температуре точки 21 заканчивается процесс кристаллизации a-твердого раствора, состав зерен соответствует исходному сплаву 1, т.к. в условиях равновесия, т.е. при очень медленном охлаждении, происходит выравнивание состава зерен за счет диффузии.
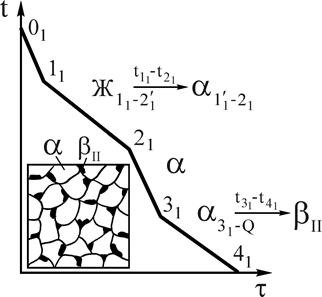 Рис.6. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре Рис.6. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре | В интервале температур 21-31 - охлаждение a-твердого раствора. Температура точки 31 соответствует предельной насыщаемости a-твердого раствора компонентом В, с понижением температуры растворимость компонента В в А снижается. Предельная растворимость в интервале температур 31-41 соответствует по диаграмме (см. рис.5) линии 31-Q, поэтому от температуры точки 31 начинается процесс вторичной кристаллизации. Из a-твердого раствора выделяется избыточный компонент В в виде b-твердого раствора, который обозначаем bII, в отличие b, выделившегося при первичной кристаллизации. Выделение фазы bII может происходить как по границам, так и внутри зерен a-твердого раствора. В точке 41 состав a-твердого раствора соответствует точке Q, а bII-точке М (см. рис.5). Кривая охлаждения приведена на рис.6. |
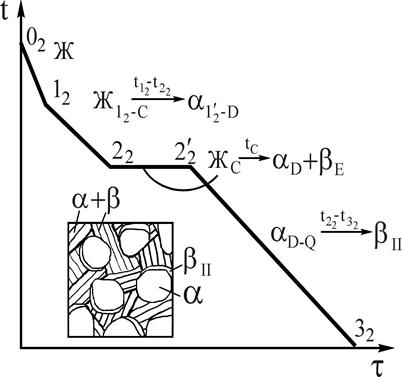 Рис.7. Кривая охлаждения и схема структуры сплава 2 при нормальной температуре Рис.7. Кривая охлаждения и схема структуры сплава 2 при нормальной температуре |
Кристаллизация доэвтектического сплава 2 начинается при температуре точки 12. В процессе кристаллизации в интервале температур 12-22 состав a-твердого раствора изменяется по линии 1¢2-D, а жидкой фазы - 12-С (см. рис.5). При температуре точки 22 жидкая фаза имеет состав точки С и затвердевает в эвтектику (участок 22-2¢2 кривой охлаждения), состоящую из a-твердого раствора состава точки D и b-твердого раствора, состава точки Е (по правилу отрезков). Охлаждение от точки 22 до точки 32 сопровождается выделением из a-твердого раствора, как структурно свободного, так и входящего в состав эвтектики b-твердого раствора (bII). Объясняется это тем, что состав a-твердого раствора уменьшается по компоненту В соответственно линии (см. рис.5) DQ. Кривая охлаждения сплава 2 приведена на рис.7.
В предыдущей диаграмме (см. рис.5) мы рассмотрели превращение, при котором жидкая фаза определенного состава кристаллизовалась в две фазы, т.е. эвтектическое превращение. Возможен и другой тип трехфазного равновесия - перитектическое превращение (рис.8).
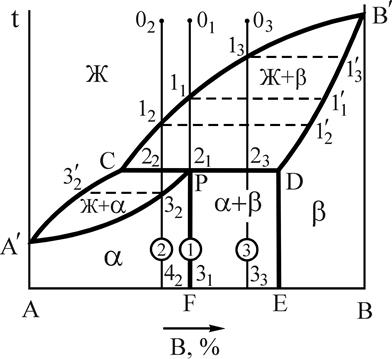 Рис.8. Диаграмма состояния системы А-В с перитектическим превращением Рис.8. Диаграмма состояния системы А-В с перитектическим превращением | Перитектическим превращением называется превращение, при котором жидкая фаза, реагируя с ранее выделившейся твердой фазой, образует новую твердую фазу. Перитектическая реакция протекает при строго определенных составах фаз, их количествах и постоянной температуре. Это превращение имеет место при кристаллизации сплавов: Cu-Zn; Cu-Sn; Cu-Al и др. Общий вид диаграммы состояния показан на рис.8. |
В данной системе компоненты: А и В (К=2), фазы: Ж, a, b (Ф=3); a-ограниченный твердый раствор компонента В в A, b-ограниченный твердый раствор компонента А в В. Линии А'СВ' - ликвидус, А'PDВ' - линии солидус, линия СРD - линия перитектического превращения, линия PF линия предельной растворимости компонента B в А, линия DЕ - предельной растворимости А в B.
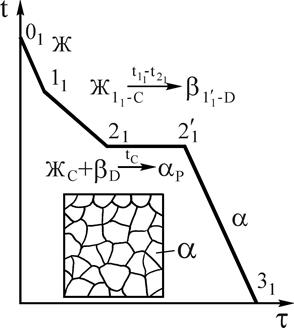 Рис.9. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре Рис.9. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре | Рассмотрим кристаллизацию трех сплавов 1, 2 и 3. До температуры точки 11 -охлаждение жидкого сплава 1. Начало кристаллизации сплава соответствует температуре точки 11, из жидкого сплава начинают кристаллизоваться кристаллы b-твердого раствора. При кристаллизации в интервале температур 11-21 состав жидкой фазы изменяется по линии ликвидус на участке 11-С, а кристаллов b-твердого раствора по линии солидус на участке 1¢1-D. При температуре точки 21, в равновесии находятся жидкая фаза состава точки С и b-кристаллы состава точки D, происходит перитектическое превращение по реакции 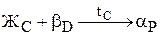 . . |
Соотношение количества жидкой фазы и кристаллов b-твердого раствора, необходимое для образования a-твердого раствора состава точки Р, с помощью правила отрезков равно 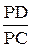 , т.е. для образования a-твердого раствора указанного состава полностью расходуется жидкая фаза и кристаллы b-твердого раствора. После перитектического превращения происходит охлаждение a-твердого раствора (участок 2¢1-31 кривой охлаждения, рис.9).
, т.е. для образования a-твердого раствора указанного состава полностью расходуется жидкая фаза и кристаллы b-твердого раствора. После перитектического превращения происходит охлаждение a-твердого раствора (участок 2¢1-31 кривой охлаждения, рис.9).
Кристаллизация сплава 2 до температуры точки 22 протекает аналогично сплаву 1 (см. рис.8 и 9).
Особо подчеркнем, что в сплавах левее точки Р перитектическое превращение происходит с избытком жидкой фазы. При температуре точки 2 произойдет перитекти-ческое превращение по реакции 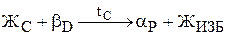
Соотношение количества жидкой фазы и кристаллов b-твердого раствора равно 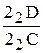 .
.
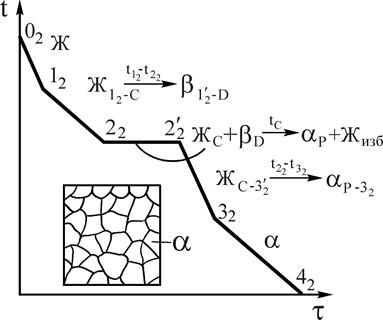 Рис.10. Кривая охлаждения и схема структуры сплава 2 при нормальной температуре Рис.10. Кривая охлаждения и схема структуры сплава 2 при нормальной температуре | Отрезок 22D больше отрезка РD, поэтому часть жидкой фазы после перитектического превращения остается неизрасходованной. При дальнейшем охлаждении в интервале температур 22-32 происходит кристаллизация избыточной жидкой фазы, из которой выделяются кристаллы a-твердого раствора. В интервале температур 32-42 - охлаждение сплава, имеющего однородные зерна a-твердого раствора. Кривая охлаждения сплава 2 приведена на рис.10. В отличие от сплава 2 в сплаве 3 перитектическое превращение протекает с избытком твердой фазы по реакции 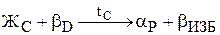 . Соотношение количества жидкой фазы и b-твердого раствора в перитектическом превращении равно . Соотношение количества жидкой фазы и b-твердого раствора в перитектическом превращении равно 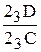 . Отрезок 23С больше отрезка PC, поэтому по окончании реакции в избытке остаются кристаллы b-твердого раствора. . Отрезок 23С больше отрезка PC, поэтому по окончании реакции в избытке остаются кристаллы b-твердого раствора. |
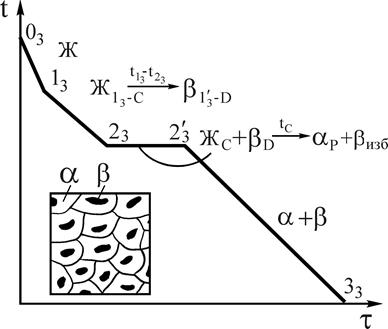 Рис.11. Кривая охлаждения и схема структуры сплава 3 при нормальной температуре Рис.11. Кривая охлаждения и схема структуры сплава 3 при нормальной температуре |
Структура этого сплава состоит из зерен a-твердого и b-твердого растворов. Характерным для данной структуры является расположение зерен избыточной фазы b внутри зерен a-твердого раствора, т.е. зерна b как бы окружены зернами a-фазы. Отсюда и название перитектического превращения (перитектика в переводе с греческого - окружение). Кривая охлаждения сплава 3 приведена на рис.11.
2.3. Диаграмма состояния сплавов с устойчивым химическим соединением
Устойчивым химическим соединением называется соединение, которое не диссоциирует на составные части до температуры плавления, т.е. при их плавлении составы жидкой и твердой фаз совпадают. Такие соединения называются конгруэнтно (соответственно) плавящимися и образуются в системах Mg-Si, Mg-Pb, W-Zr и др. Если химическое соединение АnВm образуется металлами, такое соединение стехиометрического состава принято называть интерметаллидной фазой.
На рис.12 представлены 2 варианта диаграмм с устойчивым химическим соединением, каждая из которых состоит из двух частей, разделенных фигуративной линией химического соединения. Компоненты: А и В (К=2); фазы: Ж, a, b, g (Ф=4). АnВm - химическое соединение, которое образуется при концентрации, соответствующей проекции точки С на ось концентраций, точка С соответствует температуре плавления, g - твердый раствор на базе химического соединения АnВm. Линия А¢ECРВ¢ - линия ликвидус, A¢DQCGРFB¢ - линия солидус.
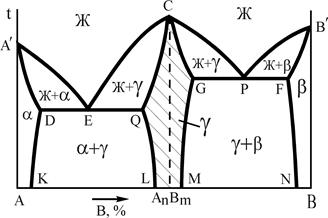 | 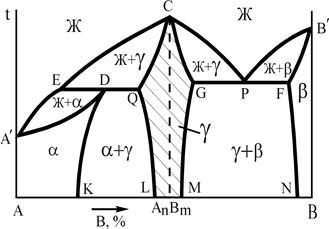 |
Рис.12. Диаграммы состояния системы А-В с устойчивым химическим соединением
Физически, выполняя функцию компонента, химическое соединение на базе своей решетки, как правило, образует по схеме замещения ограниченный твердый раствор g. Плавление (кристаллизация) g-фазы состава АnВm в соответствии с правилом фаз (С=0) происходит при постоянной температуре. Прочтение диаграмм и анализ фазового состояния системы А-В производится по частям, имея ввиду независимость систем А-АnВm и АnВm-В. Особенность диаграмм с устойчивым химическим соединением является область g-фазы. В этой области левее фигуративной линии химического соединения (заштрихована) представлены твердые растворы замещения компонента А, а правее фигуративной линии – растворы компонента В в химическом соединении. При образовании твердых растворов атомы компонента А замещают атомы компонента В в узлах кристаллической решетки соединения АnВm или наоборот. Таким образом формируется область g-раствора переменной концентрации с решеткой, свойственной химическому соединению. В силу этих особенностей g-фаза называется промежуточной.
Кристаллизацию характерных сплавов для таких диаграмм рассматривали ранее.
2.4. Диаграмма состояния для сплавов с неустойчивым химическим соединением
Неустойчивыми называются химические соединения, при плавлении которых образуется жидкая и кристаллическая фазы, отличающиеся по составу от химического соединения. При этом во взаимодействии в форме перитектического равновесия находятся три фазы определенного состава (рис.13). Такие фазы – химические соединения называются инконгруэнтно (несоответственно) плавящимися.
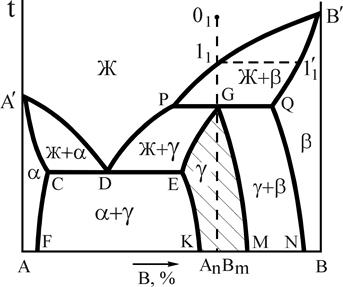 Рис.13. Диаграмма состояния системы А-В с неустойчивым химическим соединением Рис.13. Диаграмма состояния системы А-В с неустойчивым химическим соединением | При охлаждении жидкости, соответствующей по составу соединению АnВm, в интервале температур 11-G реализуется первая стадия кристаллизации в форме реакции 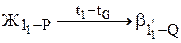 (С=1), а на уровне температуры точки G завершается кристаллизация в форме нонвариантного перитектического превращения (С=1), а на уровне температуры точки G завершается кристаллизация в форме нонвариантного перитектического превращения 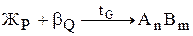 (С=0). Очевидно, что химическое соединение сохраняет свою кристаллическую структуру и состав и при более низких температурах. (С=0). Очевидно, что химическое соединение сохраняет свою кристаллическую структуру и состав и при более низких температурах. |
Другие сплавы в интервале концентраций P-Q также претерпевают перитектическое превращение, однако после своего завершения в сплавах интервала P-G в соответствии с правилом отрезков в избытке остается жидкость ЖИЗБ, а в сплавах интервала G-Q в остатке оказывается твердый раствор bИЗБ.
Промежуточная g-фаза переменного состава, формирующаяся на базе кристаллической решетки химического соединения представлена на диаграмме заштрихованной областью.
2.5. Диаграммы состояния сплавов, компоненты которых имеют полиморфные превращения
Полиморфизмом отличаются многие металлы – железо, марганец, титан, олово и др. Благодаря полиморизму компонентов сплавы в кристаллическом состоянии претерпевают превращения, которые приводят к существенному изменению структуры и свойств.
На рис.14,а показан вариант диаграммы состояния сплавов, в которых компонент А существует в двух полиморфных модификациях - a и b. При взаимодействии этих модификаций с компонентом В образуются соответствующие фазы – твердые растворы, сохраняющие при определенных концентрациях и температурах тип кристаллической решетки одного из компонентов.
 |  |
| а) | б) |
Рис.14. Диаграмма состояния (а), кривая охлаждения и фазовые реакции (б) сплава 1 системы с полиморфизмом компонента А
В сплавах в интервале концентрации C-D фазовая перекристаллизация протекает частично и поэтому в конечной структуре сосуществуют a- и b-фазы в количествах, зависящих от состава сплава.
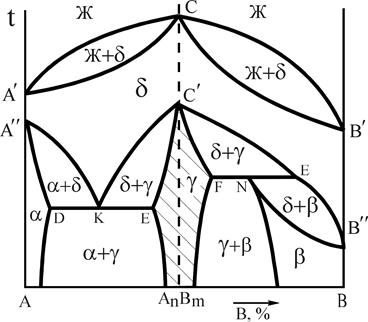 Рис.15. Диаграмма состояния системы А-В с полиморфными превращениями обоих компонентов Рис.15. Диаграмма состояния системы А-В с полиморфными превращениями обоих компонентов | На рис.15 представлен один из возможных вариантов диаграммы состояния сплава, оба компонента которого отличаются полиморфизмом. В рассмотренном случае продукт первичной кристаллизации d-раствор претерпевает фазовую перекристаллизацию с образованием a-, b- и g-растворов. Сплавы в интервале концентраций D-E проходят фазовую перекристаллизацию подобно эвтектическому превращению по реакции 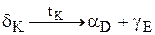 . Такое нонвариантное превращение называется эвтектоидным. . Такое нонвариантное превращение называется эвтектоидным. |
Полученная смесь фаз называется эвтектоидом. В сплавах в интервале концентраций F-Е происходит перекристаллизация в виде нонвариантного перитектоидного превращения 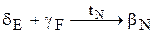 .
.
 2015-07-14
2015-07-14 23506
23506
