Устанавливается на основе того, что шаг обеих шкал одинаков (Δt =ΔT) и 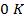 соответствует
соответствует 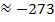 ˚. ˚С
˚. ˚С 
100 373
0 273
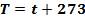
5) Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнениеМенделеева — Клапейрона) — формула, устанавливающая зависимость между давлением,молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
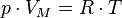 ,
,
где
· 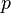 — давление,
— давление,
· 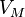 — молярный объём,
— молярный объём,
· 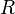 — универсальная газовая постоянная
— универсальная газовая постоянная
· 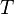 — абсолютная температура, К.
— абсолютная температура, К.
Так как 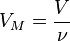 , где
, где 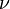 — количество вещества, а
— количество вещества, а 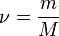 , где
, где 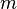 — масса,
— масса, 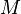 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
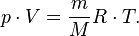
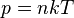 где
где 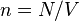 - концентрация атомов,
- концентрация атомов, 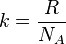 - постоянная Больцмана.
- постоянная Больцмана.
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
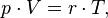
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна 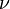 , коэффициент пропорциональности
, коэффициент пропорциональности 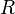 он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
КЛАПЕЙРОНА УРАВНЕНИЕ (Клапейрона - Менделеева уравнение) - зависимость между параметрами идеального газа (давлением p, объёмом V и абс. темп-рой Т), определяющими его состояние: pV=BT, где коэф. пропорциональности В зависит от массы газа М и его мол. массы. Установлен франц. учёным Б. П. Э. Клапейроном (В. Р. Е. Clapeyron) в 1834. В 1874 Д. И. Менделеев вывел ур-ние состояния для одного моля идеального газа; pV=RT, где R - универсальная газовая постоянная. Если мол. масса газа и, то
|
|
|
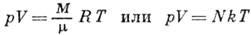
где N - число частиц газа. К. у. представляет собой уравнение состояния идеального газа, к-рое объединяет Бойля - Мариотта закон, Гей-Люссака закон и Аво-гадро закон.
К. у.- наиб. простое ур-ние состояния, применимое с определ. степенью точности к реальным газам при низких давлениях и высоких темп-рах.
 2015-07-14
2015-07-14 1479
1479








