Принимая, что теплота и работа являются двумя единственно возможными формами передачи энергии[31][32][33], а изменение энергии, связанное с переносом вещества в открытой системе, есть составная часть общей работы, называемая химической работой (работой перераспределения масс веществ[34]), в случае однородной открытой системы дифференциальную форму 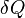 для закрытой системы следует дополнить слагаемым, учитывающим элементарную химическую работу
для закрытой системы следует дополнить слагаемым, учитывающим элементарную химическую работу 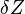 [35][36][37][38][31][32]:
[35][36][37][38][31][32]:
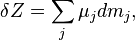 | (Химическая работа для равновесного процесса в открытой однородной системе) |
где 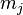 — масса j-го компонента[39],
— масса j-го компонента[39], 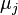 — химический потенциал этого компонента.
— химический потенциал этого компонента.
Пфаффоваформа 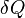 для открытой однородной системы равна[28]
для открытой однородной системы равна[28]
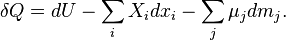 | (Первое начало для равновесного процесса в открытой однородной системе) |
Дальнейшие рассуждения о существовании энтропии
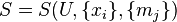
и абсолютной термодинамической температуры
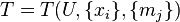
для открытой системы ничем не отличаются от соображений, высказанных при рассмотрении закрытой системы, поэтому ниже перечислены причины, по которым открытые системы потребовали отдельного рассмотрения.
Первая из этих причин состоит в том, что использование в понятийном аппарате термодинамики химической работы как части общей работы делает неэквивалентными представления об адиабатной изоляции как накладывающей запрет на обмен веществом (т. е. любая адиабатно изолированная система есть система закрытая или, говоря иначе, масса есть адиабатически заторможенная величина)[40][41][42][43], и адиабатной изоляции как допускающей обмен энергией только в форме работы[44][45]. Восстановить эквивалентность приведённых выше формулировок об адиабатной изоляции удаётся, если модифицировать дефиницию теплоты по Клаузиусу, добавив к теплоте и работе третью форму передачи энергии — энергию переноса массы 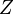 [46][47]:
[46][47]:
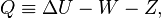 | (Модифицированная дефиниция теплоты для открытой системы) |
где 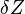 задаётся выражением для химической работы.
задаётся выражением для химической работы.
Вторая причина отдельного рассмотрения вопроса об энтропии открытых систем заключается в следующем. За исключением химического потенциала все входящие впфаффову форму 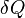 для открытой системы переменные в рамках термодинамического формализма представляют собой неопределяемые величины, заимствуемые из других разделов физики, что подразумевает необязательность их описания в самой термодинамике. Химический потенциал вводится в термодинамике и либо должен быть отнесён к базовым неопределяемым понятиям, для которых возможно только пояснительное описание, либо же от термодинамики требуется точная дефиниция химического потенциала. Как неопределяемую величину химический потенциал можно вводить одновременно с температурой и энтропией (более, того П. А. Жилин[48] считает такой подход единственно правильным[49]), но традиционно химический потенциал предпочитают вводить в рассмотрение как вторичную переменную на основе предварительно сформированного представления об энтропии открытой системы. Для этого вслед за У. Гиббсом[50][43] без доказательства принимают утверждение о существовании энтропии открытой системы[51][52][53]
для открытой системы переменные в рамках термодинамического формализма представляют собой неопределяемые величины, заимствуемые из других разделов физики, что подразумевает необязательность их описания в самой термодинамике. Химический потенциал вводится в термодинамике и либо должен быть отнесён к базовым неопределяемым понятиям, для которых возможно только пояснительное описание, либо же от термодинамики требуется точная дефиниция химического потенциала. Как неопределяемую величину химический потенциал можно вводить одновременно с температурой и энтропией (более, того П. А. Жилин[48] считает такой подход единственно правильным[49]), но традиционно химический потенциал предпочитают вводить в рассмотрение как вторичную переменную на основе предварительно сформированного представления об энтропии открытой системы. Для этого вслед за У. Гиббсом[50][43] без доказательства принимают утверждение о существовании энтропии открытой системы[51][52][53]
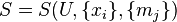 | (Энтропия открытой однородной системы по Гиббсу; фундаментальное уравнение Гиббса в энтропийном выражении) |
как функции состояния, при неизменности масс компонентов совпадающей с энтропией однородной закрытой системы. Из фундаментального уравнения Гиббса в дифференциальной форме[53]
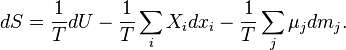 | (Дифференциальная форма фундаментального уравнения Гиббса для энтропии) |
находим значения частных производных энтропии:
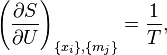
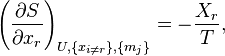
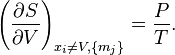
Химический потенциал k-го компонента выразим через частную производную энтропии по массе этого компонента[54]:
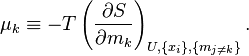 | (Дефиниция химического потенциала компонента) |
Энтропия в термодинамике Гиббса
Построение теории на основе постулирования существования энтропии как функции состояния, в состав независимых переменных которой входят массы компонентов, составляет главное содержание термодинамики Гиббса [55], а способ, каким выполнено распространение термодинамики Клаузиуса на открытые системы, позволяет говорить об аксиоматике Гиббса[56][43]. В термодинамике Гиббса вводят понятия компонента системы, фазы и многофазной гетерогенной системы, постулируют существование внутренней энергии  и энтропии
и энтропии 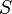 как функций состояния, постулируют связь этих функций с независимыми переменными состояния в виде фундаментальных уравнений Гиббса в энергетическом и энтропийном выражениях, постулируют аддитивность входящих в фундаментальные уравнения функций и независимых переменных, постулируют, что
как функций состояния, постулируют связь этих функций с независимыми переменными состояния в виде фундаментальных уравнений Гиббса в энергетическом и энтропийном выражениях, постулируют аддитивность входящих в фундаментальные уравнения функций и независимых переменных, постулируют, что 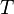 есть абсолютная термодинамическая температура, вводят химический потенциал
есть абсолютная термодинамическая температура, вводят химический потенциал 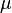 и постулируют общее условиетермодинамического равновесия в системе[57], рассматриваемое далее в числе свойств энтропии.
и постулируют общее условиетермодинамического равновесия в системе[57], рассматриваемое далее в числе свойств энтропии.
 2015-07-14
2015-07-14 1614
1614
