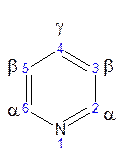 Пиридин можно рассматривать как бензол, в котором вместо одной из групп –НС= находится атом азота.
Пиридин можно рассматривать как бензол, в котором вместо одной из групп –НС= находится атом азота.
Положения в пиридиновом ядре обозначаются цифрами или буквами греческого алфавита.
Монометилпиридины называют пиколинами, диметилпиридины – лутидинами. Пиридин и его гомологи (пиколины, лутидины и т.д.), называемые «пиридиновыми основаниями», выделяют из каменноугольной смолы путем перегонки и обработки водной кислотой. Пиридин представляет собой бесцветную жидкость с tкип 115°С, обладающую характерным неприятным запахом.
Пиридин в больших количествах используется в качестве растворителя при проведении многих химических реакций, в технологии красителей и лекарственных веществ как мягкое органическое основание.
В настоящее время разработаны синтетические методы получения пиридина и его гомологов с использованием сравнительного дешевого сырья.
К таким методам относится каталитическая конденсация ацетилена с аммиаком или с синильной кислотой:
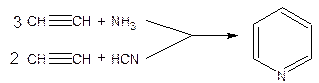
Из других методов наиболее важные основаны на конденсации карбонильных соединений с аммиаком, например акролеин образует b-пиколин:
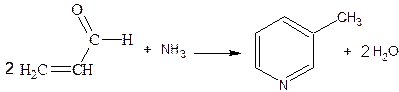
а уксусный альдегид и аммиак в присутствии ацетата аммония при 250°С дают 2-метил-5-этилпиридин:
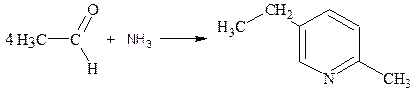
Пиридин по структуре и устойчивости из всех ароматических гетероциклов наиболее близок к бензолу, о чем свидетельствует высокое значение энергии делокализации пиридинового цикла–134,4 кДж/моль (для бензола–150,7 кДж/моль). Молекула пиридина имеет плоское строение, но не является правильным шестиугольником, так как длины связей С–N меньше, чем длины С–С-связей. Ароматический секстет p-электронов образован пятью электронами углеродных атомов и одним – атома азота. Все атомы находятся в состоянии sp2-гибридизации. Свободная пара р-электронов атома азота не взаимодействует с p-электронами кольца и расположена перпендикулярно молекулярной орбитали. Благодаря наличию этой электронной пары пиридин имеет основной характер, образуя соли пиридиния. Но основность пиридина значительно ниже основности алифатических аминов вследствие того, что атом азота пиридина включен в цикл, имеет место дополнительное взаимодействие этой электронной пары с циклической
p-электронной системой. Кроме того, sp2-орбиталь в пиридине удерживается прочнее и менее доступна для образования иона пиридиния, чем пара
р-электронов в алифатическом амине, занимающая sp3-орбиталь.
Пиридин и его гомологи образуют соли пиридиния с кислотами (HCl, HBr, H2SO4), а также с галогеналкилами.
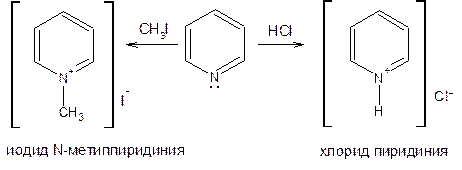
Вследствие значительного отрицательного индукционного эффекта атома азота (–I-эффект) электронная плотность смещена в сторону гетероатома, дипольный момент пиридина равен 2,26 Д.

Распределение зарядов (расчетные величины) указывает на обеднение электронами атомов углерода в цикле, особенно в a- и g-положениях, что подтверждается преимущественным электрофильным замещением в положения 3 и 5 и нуклеофильным замещением в положения 2,4,6. Таким образом, в результате значительного положительного заряда в ядре пиридина он становится инертным ко многим реакциям электрофильного замещения (алкилирование, ацилирование) и в очень жестких условиях вступает в реакции сульфирования, нитрования, бромирования:
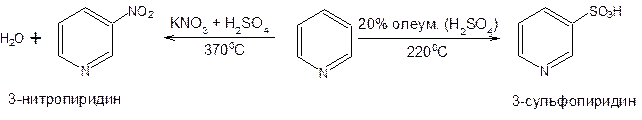
В этих реакциях проявляется большое сходство пиридина с нитробензолом, т.е. атом азота в пиридине оказывает такое же электроноакцепторное влияние, что и нитрогруппа в бензоле.
Способность пиридина к взаимодействию с нуклеофильными реагентами принципиально отличает его от бензола и еще раз указывает на сходство с нитробензолом. Это реакции: аминирование, гидроксилирование, взаимодействие с литий- и магнийорганическими соединениями.
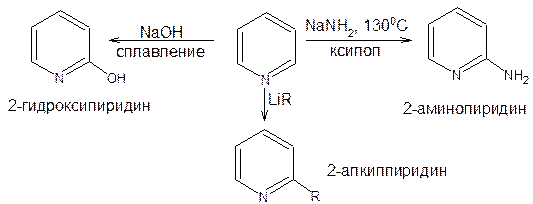
Для 2-, 4-гидроксипиридинов имеет место окси-оксо-таутомерия, причем оксо-форма является преобладающей:
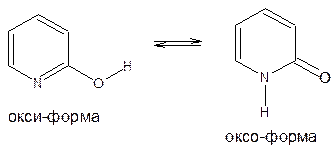
При каталитическом или электрохимическом восстановлении пиридина образуется пиперидин – гетероциклическое соединение неароматического характера, который обладает свойствами вторичных алифатических аминов:
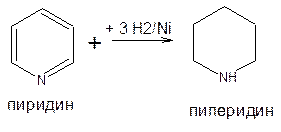
Одна из распространенных реакций пиперидина – алкилирование по атому азота.
Пиридин существенно отличается от бензола по легкости раскрытия кольца. Бензол с иодистоводородной кислотой при 280°С образует метилциклопентан, а при каталитическом гидрировании дает циклогексан. Пиридин в сходных условиях образует, соответственно, н-пентан и 1-аминопентан:
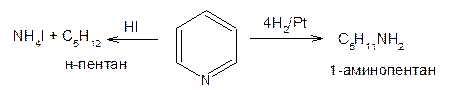
При конденсации 2-метилпиридина с формальдегидом и последующей дегидратации образующегося b-(2-пиридил)этанола получают 2-винилпиридин, применяемый (подобно стиролу) для сополимеризации с бутадиеном-1,3 в производстве специальных видов каучука:
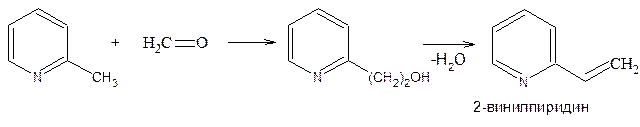
 2015-07-14
2015-07-14 3648
3648








