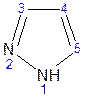 Введение второго атома азота в пиррол сильно стабилизирует молекулу, понижая электронную плотность в цикле, поэтому пиразол вступает в реакции электрофильного замещения намного труднее, чем пиррол. Ароматическая природа пиразола связана с наличием сопряженной 6p-электронной системы, в которую входят три электрона от атомов углерода и три электрона от атомов азота и имеют равную принадлежность протона каждому из этих атомов.
Введение второго атома азота в пиррол сильно стабилизирует молекулу, понижая электронную плотность в цикле, поэтому пиразол вступает в реакции электрофильного замещения намного труднее, чем пиррол. Ароматическая природа пиразола связана с наличием сопряженной 6p-электронной системы, в которую входят три электрона от атомов углерода и три электрона от атомов азота и имеют равную принадлежность протона каждому из этих атомов.
Расположенные рядом два атома азота в силу своей электроотрицательности являются источником сильного отрицательного индуктивного эффекта. Соседние с атомами азота углеродные атомы вследствие этого несут некоторый избыток положительного заряда. Поэтому реакции электрофильного замещения в пиразоле идут в положении 4, как наиболее удаленном от атомов азота:
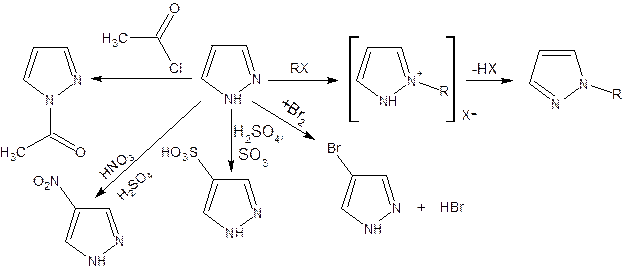
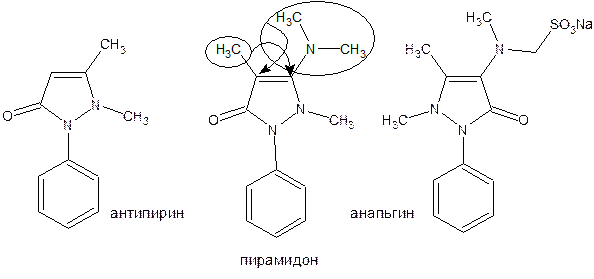
Пиразол является слабым основанием и слабой кислотой. Атом водорода при азоте довольно легко замещается на щелочные металлы, магний, серебро. Ряд производных пиразола применяются как лекарственные препараты, красители, люминесцентные вещества и др. Среди фармацевтических препаратов это: пирамидон, анальгин, антипирин и др.
 2015-07-14
2015-07-14 3242
3242








