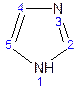
 Имидазол – более сильное основание, чем пиразол, что проявляется в образовании межмолекулярных водородных связей, а, следовательно, и в более высокой температуре его кипения по сравнению с пиразолом. Оба атома азота в имидазоле (как и в пиразоле), эквивалентны и поэтому атом водорода легко мигрирует между ними. Имидазол образует соли как с сильными кислотами, так и со щелочными и щелочноземельными металлами.
Имидазол – более сильное основание, чем пиразол, что проявляется в образовании межмолекулярных водородных связей, а, следовательно, и в более высокой температуре его кипения по сравнению с пиразолом. Оба атома азота в имидазоле (как и в пиразоле), эквивалентны и поэтому атом водорода легко мигрирует между ними. Имидазол образует соли как с сильными кислотами, так и со щелочными и щелочноземельными металлами.
Ароматическая 6p-электронная система имидазола (как и пиразола), образована за счет трех электронов атомов углерода и трех электронов атомов азота. Однако следует отметить, что в 6p-электронном сопряжении атомы азота участвуют неодинаково: один из атомов азота отдает в ×p-электронную систему электрон (пиридиновый азот), а другой атом азота – два электрона (пиррольный азот).
Реакции электрофильного замещения в ряду имидазола могут протекать либо по атомам азота (алкилирование и ацилирование), либо по атомам углерода в положения 4 и 5 по месту наибольшей электронной плотности: нитрование, сульфирование, галогенирование. Например, замещенный 4,5-диметилимидазол не вступает в реакцию нитрования.
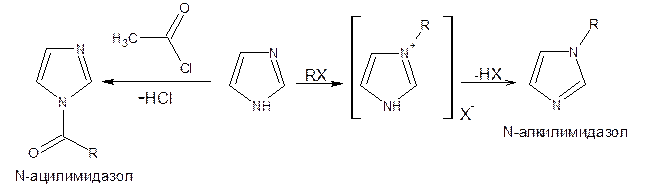
Ацилирование имидазола имеет большое биологическое значение: с помощью N-ацилимидазолов осуществляются реакции ферментативного переацилирования.
 2015-07-14
2015-07-14 3136
3136








