Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
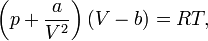
где
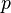 — давление,
— давление,
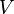 — молярный объём,
— молярный объём,
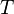 — абсолютная температура,
— абсолютная температура,
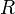 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка 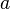 учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка 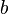 — объем молекул газа.
— объем молекул газа.
Для 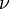 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
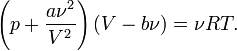
где
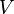 — объём,
— объём,
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:
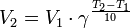
где 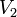 — скорость реакции при температуре
— скорость реакции при температуре 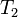 ,
, 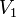 — скорость реакции при температуре
— скорость реакции при температуре 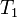 ,
, 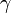 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
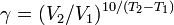
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции 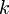 от температуры
от температуры 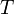 .
.
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 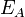 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 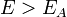 , пропорционально
, пропорционально 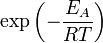 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
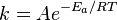
Здесь 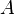 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 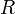 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений 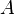 зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:
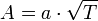
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 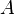 на 10 %.
на 10 %.
В рамках теории активированного комплекса получаются другие зависимости 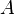 от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением
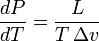
где 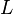 — удельная теплота фазового перехода,
— удельная теплота фазового перехода, 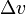 — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.
Уравнение названо в честь его авторов, Рудольфа Клаузиуса и Бенуа Клапейрона.
 2015-07-21
2015-07-21 683
683







