Электродные потенциалы. Электрод. Абсолютный и относительный электродный потенциалы. Водородная шкала относительных электродных потенциалов. Факторы, влияющие на величину относительного электродного потенциала (уравнение Нернста).
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Электрод - часть электрохимической системы, включающая в себя (металлический) проводник и окружающий его раствор (например, Водородный электрод, Хлорсеребряный электрод, Электрод сравнения). Проводник, посредством которого часть электрической цепи, образуемая проводами, соединяется с частью цепи, проходящей в неметаллической среде (ионной жидкости, ионизированном газе и т.п.).
Положительный электрод – анод.
Отрицательный электрод – катод.
Если электродная реакция, записанная в сторону восстановления, является самопроизвольной, то потенциал электрода положителен.
Электродный потенциал в электрохимии - разность электрических потенциалов на границе фаз электрод - электролит. На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода сравнения (напр., нормального водородного). Абсолютное значение электродного потенциала измерить невозможно, поэтому измеряют всегда разность электродных потенциалов — относительный электродный потенциал. Если электродная реакция проходит в равновесных обратимых условиях (при токе, стремящемся к нулю), скачок потенциала между электродом и электролитом называют равновесным потенциалом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
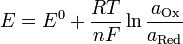 ,
,
где
-
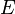 — электродный потенциал,
— электродный потенциал, 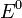 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах; -
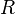 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K); -
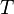 — абсолютная температура;
— абсолютная температура; -
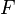 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1; -
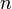 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе; -
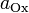 и
и 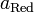 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 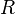 и
и 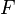 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 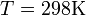 получим
получим
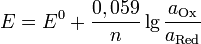
 2015-07-21
2015-07-21 18896
18896