Т - первичная опухоль;
Тх - недостаточно данных для оценки первичной опухоли;
ТО - первичная опухоль не определяется.
Tis - преинвазивная карцинома (carcinoma in citu);
Tl - опухоль инфильтрирует стенку пищевода до подслизистого слоя;
Т2 - опухоль инфильтрирует стенку пищевода до мышечного слоя;
ТЗ - опухоль инфильтрирует стенку пищевода до адвентиции;
Т4 - опухоль распространяется на соседние структуры.
N - Регионарные лимфатические узлы верхней трети пищевода:
надключичные,
паратрахеальные,
бифуркационные,
средней трети пищевода:
параэзофагиальные,
паратрахеальные,
бифуркационные,
паракардиальные.
нижней трети пищевода:
параэзофагеальные,
бифуркационные,
паратрахеальные,
паракардиальные,
лимфатические узлы малого сальника.
Nx - недостаточно данных для оценки регионарных лимфатических узлов;
No - нет признака поражения регионарных лимфатических узлов;
N1 - имеется поражение регионарных лимфатических узлов метастазами;
М - отдаленные метастазы:
Мх - недостаточно данных для определения отдаленных метастазов;
Мо - нет признаков отдаленных метастазов.
Ml - имеются отдаленные метастазы
Клиника. Клинические признаки рака пищевода подразделяют на три основные группы:
1) симптомы поражения пищевода;
2) общие симптомы;
3) симптомы вовлечения в патологический процесс соседних органов.
Первую группу составляют признаки, вызванные сужением просвета пищевода, нарушением его проходимости и инфильтрацией стенки пищевода опухолью (дисфагия, ощущение полноты и распирания за грудиной, повышенное слюноотделение, неприятный вкус во рту, тошнота, срыгивание принятой пищи, плохой запах изо рта), а также различного характера болевые ощущения.
Дисфагия – наиболее характерный признак рака пищевода, встречающийся у 70-95% больных. В начальных стадиях заболевания дисфагия может возникнуть внезапно во время торопливой еды и при проглатывании больших порций твердой пищи и носит выраженный характер. После приема жидкости или вызванной самим больным рвоты дисфагия обычно исчезает, и больной длительное время может не придавать ей значения. Поэтому лишь повторные приступы заставляют его обратиться к врачу.
Ранними симтомами рака среднего и нижнего отделов пищевода являются симптомы преходящего спазма, локализующегося у входа в пищевод и, в особенности, спазм кардии при локализации опухоли в юкстакардиальной части желудка.
В последующем дисфагия постепенно усиливается и приобретает стойкий характер или же появляются частые приступы острой дисфагии. При этом в ее возникновении играет роль как спазм, который поддерживается местными воспалительными явлениями, так и сужение просвета пищевода растущей опухолью. Через некоторое время дисфагия проявляется даже при приеме жидкости. Больной начинает худеть.
В более поздних стадиях заболевания, наряду с нарастанием дисфагии и болезненностью при прохождении пищи, наблюдается расширение пищевода. При резком сужении пищевода появляются ощущения полноты и распирания за грудиной, срыгивание, обусловленное скоплением принятой пищи в расширенном участке пищевода с нарушением перистальтики. Регургитация более выражена при высокой локализации рака. При скоплении пищи в пищеводе выше места сужения возможны приступы рвоты, которая наступает через несколько часов после еды и может симулировать желудочную рвоту. В некоторых случаях может внезапно улучшиться прохождение пищи в результате распада опухоли.
У ряда больных наблюдаются снижение аппетита, отвращение к мясной пище, вздутие живота, изменение характера стула (упорный понос или запор). У некоторых больных единственной жалобой является упорная отрыжка. По данным Е.А.Печатниковой, она может быть первым симптомом кардиального рака.
У 10-30% больных в результате хронической непроходимости пищевода возникает усиленное слюноотделение, интенсивность которого прямо пропорциональна степени сужения пищевода.
Боль может возникать самостоятельно или же она связана с дисфагией. Частота этого признака как первого симптома заболевания составляет от 5,5 до 12,4%. Боль при раке пищевода отличается своим характером (тупая или острая), локализацией (в области шеи, грудной клетки или в надчревной области), иррадиацией (в ту или иную часть грудной клетки или брюшной полости). В начальных стадиях заболевания обычно отмечается непостоянная боль во время еды и спустя некоторое время после нее. Боль может быть прерывистой или постоянной. Прерывистая боль возникает при глотании, прохождении пищи. Она ощущается за грудиной, на уровне расположения опухоли и несколько выше нее. Эта боль обусловлена изъязвлением опухоли, раздражением воспаленной слизистой оболочки пищевода и опухоли перистальтической волной, а также явлениями сопутствующего эзофагоспазма. Постоянная, тупая, сверлящая боль ощущается несколько выше опухоли и вызывается прорастанием опухоли в околопищеводную клетчатку со сдавлением нервных стволов, явлениями периэзофагита и медиастинита.
В поздних стадиях заболевания причиной боли может быть прорастание опухоли в позвоночник.
Наряду с признаками поражения пищевода наблюдаются общие симптомы, которые у ряда больных могут преобладать над местными и даже предшествовать им. К ним относятся быстрая утомляемость, снижение работоспособности, раздражительность, потеря массы тела, анемия, повышение температуры тела, нарушение сна. В результате интоксикации больные легко устают, теряют интерес к окружающему, к выполняемой работе. Вследствие постоянной длительной кровопотери развивается анемия. Инфицирование опухоли, всасывание продуктов ее распада являются причиной повышения температуры тела. Уменьшение количества принимаемой пищи и жидкости приводит потере массы тела, обезвоживанию организма и сгущению крови.
К симптомам вовлечения в процесс соседних органов относятся охриплость голоса при поражении возвратных нервов, мучительный кашель при прорастании опухоли в бронх, синдром Горнера при поражении симпатического ствола. При прорастании опухоли в легкое и плевру могут развиться пневмония, абсцесс легкого и эмпиема плевры. Прорастание опухоли в бронх и распад ее приводят к образованию пищеводно-бронхиального свища. Результатом прорастания опухоли в соседние органы могут быть также перикардит, медиастинит, кровотечение из крупных сосудов.
У ряда больных раком пищевода в клинической картине могут преобладать симптомы, характерные для заболеваний других органов. Такие формы рака пищевода А.И.Рудерман называет "масками", выделяя ларинго-трахеальную, сердечную, плевро-пульмональную, гастритическую, невралгическую и смешанные "маски". Частота их высока и составляет 51%.
Клиническая картина рака пищевода зависит от локализации опухоли. Для рака шейной части и верхней трети грудного отдела пищевода характерен симптом глоточной недостаточности. При этой локализации рака рано появляется и быстро нарастает дисфагия, которая может уменьшится при распаде опухоли. Состояние больного усугубляет боль, возникающая как при глотании, так и независимо от него. Поражение возвратного нерва вызывает охриплость голоса. При сдавлении или прорастании опухоли в трахею появляется надсадный загрудинный кашель. В поздних стадиях может образоваться пищеводно-трахеальный свищ.
Рак средней трети грудного отдела пищевода чаще всего проявляется дисфагией или болью. Вначале незначительная дисфагия быстро прогрессирует, периодически возникает пищеводная рвота, постепенно усиливается боль, появляются общие симптомы.
В клинической картине рака нижней трети грудной части пищевода и рака кардиального отдела ведущим симптомом также является быстро нарастающая дисфагия, наряду с которой выражены общие симптомы (стенокардия рефлекторного характера, анемия и др.).
Диагностика. Диагностика рака пищевода должна быть комплексной и основываться на результатах клинического обследования больного, рентгенологического, эндоскопического и морфологического методов исследования. С помощью указанных методов диагностики необходимо решить две задачи: 1) выявить и морфологически подтвердить рак пищевода; 2) установить степень распространения опухолевого процесса.
Клиническое обследование больного включает прежде всего тщательный сбор анамнеза. При осмотре больного необходимо отметить состояние кожных покровов (цвет, тургор), выраженность подкожной жировой клетчатки, наличие или отсутствие при пальпации болей в эпигастральной области и правом подреберье, состояние надключичных и других групп периферических лимфатических узлов. Аускультация и перкуссия при неосложненных формах рака пищевода малоинформативны.
Рентгенологическое исследование наряду с исследованием пищевода должно включать исследование желудка (при отсутствии полного стеноза просвета пищевода) и легких (с обязательной томографией средостения на уровне корней легких).
Рентгенологическое исследование пищевода направлено на выявление возможного сужения просвета пищевода и супрастенотического расширения органа (асимметрично-бокаловидное расширение - симптом Тримадо); обнаружение ригидности стенок и изменение рельефа слизистой оболочки; определение протяженности опухолевого поражения и локализации его, согласно сегментарному делению пищевода; выявление изъязвления или свища в зоне опухоли; определение глубины инвазии стенки пищевода и выраженности параэзофагеального ("мягкотканного") компонента опухоли; выявление сопутствующих заболеваний пищевода.
При сохранении проходимости пищевода для контрастной массы выполняют рентгенологическое исследование желудка. Оно направлено на выявление возможного распространения опухоли на проксимальный отдел желудка; определение размеров желудка и возможных деформаций его, особенно в верхней трети и зоне малой кривизны. Указанное может быть проявлением метастатического поражения малого сальника, паракардиальных и забрюшинных лимфатических узлов; а также диагностики сопутствующих заболеваний желудка.
Рентгенологическое исследование легких направлено на выявление возможного метастатического поражения легочной ткани и плевры, увеличения лимфатических узлов средостения, острых и хронических заболеваний.
Эндоскопические методы исследования включают эзофагоскопию, гастроскопию (если можно провести эндоскоп через зону опухоли), трахеобронхоскопию и лапароскопию (при подозрении на метастатическое поражение печени). Эзофагоскопию выполняют для определения возможных изменений слизистой оболочки пищевода, опухолевого поражения пищевод и макроскопической его картины верхней и, по возможности, нижней границ опухоли и получения материала для гистологического (не менее четырех кусочков) и цитологического исследований. В тех случаях, когда возможно выполнить гастроскопию, определяют состояние слизистой оболочки желудка и границы возможного перехода опухоли из пищевода в желудок. При трахеобронхоскопии проводят визуальную оценку состояния бронхиального дерева, выявляют возможное сужение просвета трахеи или главных (долевых) бронхов вследствие сдавления извне, прорастания их опухолью или метастатическими лимфатическими узлами, определяют расстояние до карины.
Эндоскопическое исследование и биопсию следует считать особо важными в диагностике рака пищевода. Эзофагоскопия с биопсией в 97% наблюдений дают достоверную информацию. Ранними признаками РП пищевода являются локальное утолщение и ригидность стенки, участок измененного цвета, сглаженность складок, некротические массы и фибринозные налеты, сужение просвета.
Большую помощь в решении вопроса о целесообразности торакотомии и операции вообще может оказать компьютерная томография, которую следует всегда выполнять у больных раком верхней и средней третей грудного отдела пищевода. Это исследование в 80-85% наблюдений позволяет выявить инвазию опухоли на трахею, бронхи, крупные сосуды, что дает основание отказаться от операции. Компьютерную томографию желательно выполнять у всех больных, особенно при опухолях, протяженностью более 7-10 см.
Ультразвуковое исследование, как правило, позволяет выявить наличие метастазов в других органах.
В общем анализе крови отмечают умеренную анемию, снижение количества лимфоцитов и ускорение СОЭ.
Морфологические методы исследования включают обязательное гистологическое и цитологическое исследования материала, полученного во время эндоскопических исследований или при пункции опухолевых образований, подозрительных на их метастатическое происхождение.
Комбинированное и комплексное лечение. В настоящее время при раке пищевода используют лучевой, хирургический и комбинированный (предоперационная лучевая терапия с последующей операцией) методы лечения. Лекарственная терапия как самостоятельный метод пока не получила распространения из-за отсутствия эффективных противоопухолевых препаратов. По этим же причинам не находят широкого применения и химиотерапия с лучевым лечением.
Лечение рака пищевода зависит от локализации и стадии опухоли. При локализации в шейном и верхнегруденом отделах хирургическое лечение может быть эффективным лишь в начальных стадиях рака, которые встречаются чрезвычайно редко. При опухолях этой локализации рано возникают метастазы, опухоль, быстро развиваясь, прорастает окружающие ткани (обычно трахею). Поэтому при опухолях шейного и верхнегружного отделов пищевода чаще применяют лучевое лечение по так называемой радикальной программе (суммарная доза 60 Гр).
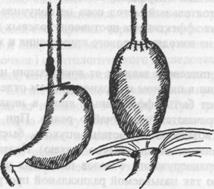 При комбинированном лечении рака среднегрудного отдела пищевода проводят предоперационное облучение на бетатроне (или телегамматерапию) с суммарной дозой 35-40 Гр, а затем производят операцию. Классическим вмешательством при локализации рака в средне-грудном отделе пищевода является операция Добромыслова-Торека (рис. 5). Спустя 3-6 мес. выполняется пластика пищевода желудком, толстой или тонкой кишкой. У относительно крепких больных возможно выполнение одноэтапной операции - экстирпации и пластики пищевода (обычно желудочным стеблем).
При комбинированном лечении рака среднегрудного отдела пищевода проводят предоперационное облучение на бетатроне (или телегамматерапию) с суммарной дозой 35-40 Гр, а затем производят операцию. Классическим вмешательством при локализации рака в средне-грудном отделе пищевода является операция Добромыслова-Торека (рис. 5). Спустя 3-6 мес. выполняется пластика пищевода желудком, толстой или тонкой кишкой. У относительно крепких больных возможно выполнение одноэтапной операции - экстирпации и пластики пищевода (обычно желудочным стеблем).
ß Рис. 5. Схема операции Добромыслова-Торека (при раке средней трети пищевода).
При локализации опухоли в нижней трети пищевода выполняют резекцию пищевода с одномоментным эзофагогастроанастомозом (операция Льюиса) (рис. 6).
Рис.6. Схема операции Льюиса при раке нижней трети пищевода (из левостороннего торакотомного оперативного доступа). à
Проблема лечения рака пищевода не только онкологическая, но и гериатрическая. Возраст 82% больных раком пищевода более 60 лет и 49% - более 70 лет. Для больных раком пищевода в пожилом возрасте характерно наличие сопутствующих заболеваний сердечно-сосудистой системы и органов дыхания. В связи с этим отмечается известный скептицизм в отношении возможности проведения хирургического и комбинированного лечения у больных раком пищевода. Поэтому в большинстве случаев отдается предпочтение лучевой терапии.
Лучевая терапия противопоказана при декомпенсированных заболеваниях сердечно-сосудистой системы, хронических заболеваниях легких с симптомами выраженной легочной недостаточности, тяжелых поражений печени, нервной системы, а также прорастание опухоли пищевода в бронхи, трахею, аорту, распаде опухоли с признаками кровотечения и свищей, выраженной кахексии. Туберкулез легких в активной фазе также является противопоказанием к лучевой терапии, однако некоторых больных можно попытаться лечить на фоне проведения специфической противотуберкулезной терапии. К дополнительным противопоказаниям к лучевой терапии следует отнести сахарный диабет 2-3 степени и изменения в периферической крови: уменьшение количества лейкоцитов (менее 3-10 х 109 /л), тромбоцитов (менее 100 X 10%), снижение уровня гемоглобина (менее 80 г/л).
При раке грудного отдела пищевода любой локализации, кардио-эзофагеальном раке (в случаях, когда опухоль переходит на грудной отдел пищевода) I-II ст. возможна экстирпация пищевода из шейно-абдоминального доступа с одномоментной эзофагопластикой изоперистальтическим желудочным стеблем с расположением трансплантата в заднем средостении (рис. 7).
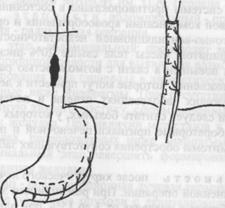
ß Рис.7. Схема одномоментная пластика пищевода абдомино-цервикальным доступом.
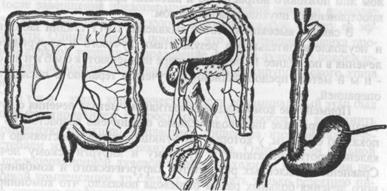 В ситуациях, когда желудок невозможно использовать для эзофа-гопластики, возможно применение трансплантата из толстого кишечника (преимущественно из левой его половины) (Рис. 8).
В ситуациях, когда желудок невозможно использовать для эзофа-гопластики, возможно применение трансплантата из толстого кишечника (преимущественно из левой его половины) (Рис. 8).
Рис.8. Пластика пищевода толстой кишкой. à
Противопоказания к одномоментной эзофагопластике определяются общим состоянием больного, так и характером патологического процесса (протяженнос-тью опухоли, более 12-14 см, степенью инвазии на окружающие ткани и органы, переходом опухоли на желудок). Возраст больных 75 лет следует считать предельным для одномоментной пластики пищевода.
Оперативное лечение при сопутствующих заболеваниях сердечно-сосудистой системы противопоказано в состоянии декомпенсации или неустойчивой компенсации кровообращения и органов дыхания с явлениями легочно-вентиляционной недостаточности 4 степени. У больных с дефицитом массы тела свыше 20% риск хирургического вмешательства повышен в связи с возможностью развития послеоперационных осложнений, которые могут привести к летальному исходу. При сопутствующих заболеваниях печени и почек функционально операбельными следует считать больных, у которых отсутствуют клинические и лабораторные признаки печеночной и почечной недостаточности и симптомы обострения сопутствующих заболеваний.
Летальность после хирургического лечения рака зависит от типа выполненной операции. При резекции или экстирпации пищевода она колеблется в пределах от 3 до 15%, при одномоментных операциях - от 20 до 30%. Основными причинами летальных исходов являются сердечно-сосудистая недостаточность, пневмония и гнойные осложнения. Пятилетняя выживаемость больных после хирургического лечения не превышает 20-25%.
Таким образом, ограниченные возможности хирургического лечения больных раком пищевода обусловлены не только большим числом лиц пожилого возраста, но и высоким процентом больных с распространенным опухолевым процессом.
В связи с высокой частотой выявления III-IV стадий заболевания и неудовлетворительными результатами лучевого и хирургического лечения в последнее 10-летие все шире применяют комбинированный метод: предоперационную лучевую терапию с последующей операцией.
Применение комбинации оперативного метода лечения с лучевой терапией при раке пищевода условно ограничено возрастом 65 лет и показано больным, у которых по функциональному состоянию не выявлено противопоказаний к лучевому и хирургическому лечению. Сравнение отдаленных результатов хирургического и комбинированного лечения больных раком пищевода показало, что комбинированный метод при опухолях, размером до 5 см (Т1-2), не имеет преимуществ перед монооперативным, а при опухолях протяженностью более 5 см (Т3-4) значительно превосходит его. Из этого следует, что комбинированное лечение РП показано при распространенном опухолевом процессе (опухоли размером более 5 см), т.е. у тех больных, которые в основном и поступают в онкологическое стационары.
В основу комбинированного хирургического лечения с лучевой терапией (согласно данным МНИОИ им. П.А. Герцена 1989 г) положен принцип этапности: абдоминальный - предоперационная лучевая терапия - радикальная операция.
Первый этап - абдоминальный: производят лапаротомию с ревизией органов брюшной полости для выявления возможного регионарного метастазирования рака пищевода в лимфатические узлы и органы, расположенные ниже диафрагмы. При отсутствии метастазов выполняют первичную эзофагопластику, сформированным стеблем из большой кривизны желудка. При наличии метастазов в регионарных лимфатических узлах, расположенных ниже диафрагмы, их следует удалить, а абдоминальный этап завершить формированием гастростомы у малой кривизны желудка.
Второй этап - предоперационная лучевая терапия, направленная на повреждение элементов опухоли с девитализацией ее клеток, частичную регрессию и уменьшение размеров опухоли. Повреждение элементов опухоли в окружающей клетчатке и субклинических метастазов в регионарных лимфатических узлах, устранение или уменьшение неспецифических воспалительных изменений как в самой опухоли, так и вокруг нее создают более абластичные условия для выполнения операции, повышают резектабельность опухоли и онкологический радикализм операции.
После завершения предоперационной лучевой терапии проводят клиническую, рентгенологическую и эндоскопическую оценку ее эффективности. Однако, следует помнить, что качественная оценка проведенной лучевой терапии - определение степени лучевого повреждения опухоли, возможна лишь после выполнения хирургического этапа лечения.
Третий этап - хирургический. Если абдоминальный этап был завершен формированием гастростомы, то целесообразно выполнить одномоментную резекцию и пластику пищевода изоперистальтическим стеблем из большой кривизны желудка. Однако, если больной после предоперационной лучевой терапии находится в состоянии неустойчивой компенсации, то следует выполнить только резекцию пищевода, отложив эзофагопластику на 3-4 мес.
В случае завершения абдоминального этапа первичной эзофагопластикой на третьем этапе производят резекцию пищевода, которую при надежном кровоснабжении шейного отрезка пищевода можно сочитать с одномоментным формированием внеполостного пищеводно-желудочного анастомоза на шее. Независимо от варианта эзофагопластики следует использовать подкожное проведение трансплантанта.
Описанные три этапа обязательны при проведении комбинированного лечения. Вместе с тем очередность первого и второго этапов может быть изменена. В ситуациях, когда резектабельность опухоли не вызывает сомнения, а вероятность метастазирования ее в органы брюшной полости низка, лучевая терапия может быть предпринята до абдоминального этапа, который становится частью хирургического этапа и всегда начинают с лапаротомии, производя при этом оценки состояния лимфатических узлов и органов брюшной полости.
Анализ отдаленных результатов (Мамонтов А.С. с соав., 1985) показывает, что при комбинированном хирургическом лечении с предоперационной лучевой терапией они улучшаются во все сроки наблюдения. Трехлетняя выживаемость после комбинированного лечения в группе радикально оперированных больных составляет 48,8%; в группе больных, перенесших лечение - 35,9%; при паллиативных резекциях - 2,1%. Увеличение интервала между окончанием лучевого и началом хирургического этапов комбинированного лечения приводит к появлению признаков продолженного роста опухоли, что служит неблагоприятным прогностическим фактором. Выживаемость больных, у которых не отмечено признаков продолженного роста, в сроки 1 и 3 года составила соответственно 72,7 и 50%, а при его появлении - 53,3 и 34,2%.
Паллиативные операции при неоперабельном раке пищевода представлены различными видами гастростомий (Витцеля, Топровера, Кадера, Бек-Жиано).
Химиотерапия эффективна у 19-28% больных. Встречающиеся гистологические формы рака пищевода наиболее чувствительны к цисплатину, метатрексату, олеомицину и проспидину. Указанные лекарственные препараты вводятся по схеме, состоящей из 5 курсов сочетания этих препаратов.
 2015-08-21
2015-08-21 1045
1045








