Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему - «пируватдегидрогеназный комплекс».
I стадия: пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+.
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 коферментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД
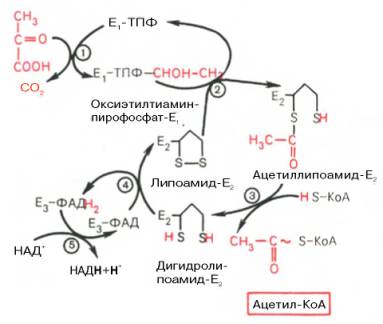
Механизм действия пируватдегидрогеназного комплекса. Е1 - пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3 -дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.
Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.
Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). происходит в митохондриях клеток.
28. ТРИКАРБОНОВЫХ КИСЛОТЦИКЛ (цикл Кребса)
Суммарная р-ция трикарбоновых кислот цикла у животных имеет вид:
CH3C(O)SKoA + 3НАД + ФАД + ГДФ + + Н2О:: 2СО2 + 3НАДН + ФАДН + ГТФ + 2Н + KoASH
Общее уравнение одного оборота цикла Кребса:
Ацетил-КоА → 2CO2 + КоА + 8e−
широко представленный в организмах животных, растений и микробов путь окислительных превращений ди- и трикарбоновых кислот, образующихся в качестве промежуточных продуктов при распаде белков, жиров и углеводов.
локализован в митохондриях, начинается с лимонной кислоты и заканчивается образованием щавелевоуксусной кислоты, CO2 и восстановлением коферментов дегидрогеназ: НАД и ФАД.
К субстратам относятся трикарбоновые кислоты — лимонная, цис-аконитовая, изолимонная, щавелевоянтарная и дикарбоновые кислоты — кетоглутаровая, янтарная, фумаровая, яблочная и щавелевоуксусная и уксусная кислота, которая в активной форме (ацетилкофермента А (ацетил-КоА)), участвует в конденсации с щавелевоуксусной кислотой, приводящей к образованию лимонной кислоты.
ацетильный остаток в структуре лимонной кислоты, подвергается окислению; атомы углерода окисляются до CO2, атомы водорода частично акцептируются коферментами дегидрогеназ, частично в протонированной форме переходят в раствор, то есть в окружающую среду.
пируват, образующуюся при Гликолизе в реакциях переаминирования и занимающую одно из центральных мест в перекрещивающихся путях обмена веществ, как на исходное соединение для образования ацетил-КоА. под влиянием фермента сложной структуры — пируватдегидрогеназы — осуществляется окисление пирувата с образованием CO2 (первое декарбоксилирование), ацетил-КоА и происходит восстановление НАД.
Образование лимонной кислоты - реакция эндергоническая, и её реализация возможна благодаря использованию богатой энергией связи ацетильного остатка с KoA. Далее следует изомеризация лимонной кислоты в изолимонную через промежуточную стадию образования цис-аконитовой кислоты. Продуктом дальнейшего превращения изолимонной кислоты под влиянием дегидрогеназы является щавелевоянтарная кислота, декарбоксилирование которой (вторая молекула CO2) приводит к α- кетоглутаровой кислоте.
Кетоглутаратдегидрогеназа по ряду характеристик (высокая молекулярная масса, сложная многокомпонентная структура, ступенчатые реакции, частично те же коферменты и т.д.) напоминает действие пируватдегидрогеназы. Продуктами реакции являются CO2 (третье декарбоксилирование), НАДН․Н+ и сукцинил-КоА. На этой стадии включается сукцинил-КоА-синтетаза, катализирующая обратимую реакцию образования свободного сукцината: Сукцинил-КоА + Рнеорг. + ГДФ ⇔ Сукцинат + KoA + ГТФ. При этой реакции осуществляется так называемое субстратное фосфорилирование, то есть образование богатого энергией гуанозинтрифосфата (ГТФ) или аденозинтрифосфата (АТФ) за счёт гуанозиндифосфата (ГДФ) и минерального фосфата (Р) с использованием энергии сукцинил-КоА. После образования сукцината вступает в действие сукцинатдегидрогеназа — флавопротеид, приводящий к фумаровой кислоте. Фумараза обеспечивает равновесие между фумаровой кислотой и яблочной, а дегидрогеназа яблочной кислоты (кофермент — НАД+) приводит к завершению Т. к. ц., то есть к образованию щавелевоуксусной кислоты. На этой стадии повторяется реакция конденсации (конденсирующий фермент) между щавелевоуксусной кислотой и ацетил-КоА, приводящая к образованию лимонной кислоты.
Энергетическая эффективность рассмотренных процессов невелика. Однако образующиеся при окислении пирувата и последующих реакциях Т. к. ц. 4 моля НАДН, 1 моль ФАДН2 и 3 моля CO2 являются важными продуктами окислительных превращений. Особенно это касается восстановленных форм НАД и ФАД. Дальнейшее их окисление осуществляется ферментами дыхательной цепи и сопряжено с фосфорилированием, то есть образованием АТФ за счёт этерификации минерального фосфата. На каждую полностью окисленную до CO2 и H2O молекулу пирувата приходится образование не менее 15 богатых энергией фосфатных связей. Процесс окисления НАДН и ФАДН2 ферментами дыхательной цепи энергетически весьма эффективен, происходит с использованием кислорода воздуха, приводит к образованию воды и служит основным источником энергетических ресурсов клетки. Однако в его непосредственной реализации ферменты Т. к. ц. не участвуют.
30. Дегидрогеназы — группа ферментов из класса оксидоредуктаз, катализирующих перенос протонов от субстрата (орган веществ) и пары электронов — к акцептору.
Важную роль играют митохондриальные цитохромредуктазы (флавопротеиды), ферменты, отщепляющие протоны в клетках животных, растений и микробов от восстановленных коферментов и передающие электроны на цитохром.
Дегидрогеназы представлены в реакциях углеводного (цикл Кребса, пируватдегидрогеназа) и жирового обмена, окисления изоцитратдегидрогеназа, альфакетоглутаратдегидрогеназа.
В качестве акцептора выступает обычно НАД/НАДФ или флавиновый кофермент, например ФАД или ФМН.
Многие дегидрогеназы в активном центре содержит ионы металлов — цинк, марганец. и также другие.
31. Во время четвертой реакции ЦТК происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.
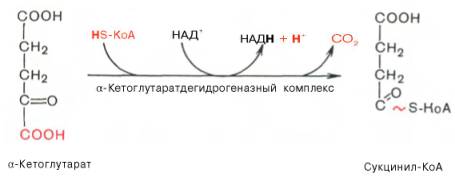
32. ДЕКАРБОКСИЛИРОВАНИЕ, элиминирование СО2 из карбоксильной группы карбоновых к-т или карбоксилатной группы их солей.
Существует два типа подобных р-ций: простое декарбоксилирование (обратимая р-ция) и окислительное декарбоксилирование, в к-ром происходит сначала декарбоксилирование, а затем дегидрирование субстрата. По последнему типу в организме животных и растений осуществляется ферментативное декарбоксилирование пировиноградной и a-кетоглутаровой к-т - промежуточных продуктов распада углеводов, жиров и белков
12. гликолиз— один из древнейших метаболических процессов, известный почти у всех живых организмов.
В клетках эукариотических организмов десять ферментов, катализирующих распад глюкозы до ПВК, находятся в цитозоле, все остальные ферменты, имеющие отношение к энергетическому обмену, — в митохондриях и хлоропластах. Поступление глюкозы в клетку осуществляется двумя путями: натрий-зависимый симпорт (преимущественно для энтероцитов и эпителия почечных канальцев) и облегчённая диффузия глюкозы с помощью белков-переносчиков. Работа этих белков-транспортёров контролируется гормонами и, в первую очередь, инсулином. Сильнее всего инсулин стимулирует транспорт глюкозы в мышцах и жировой ткани.
Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
(глюкоза)n + 3Фнеорг. + 3АДФ = 2лактат + (глюкоза) n-1, где Фнеорг. — неорганический фосфат. При полном аэробном расщеплении одной молекулы глюкозы (через стадию образования ацетил-КоА из пирувата) образуется 38 молекул АТФ.
20. Циклический аденозинмонофосфат (циклический AMФ, цAMФ, cAMP) — производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых гормонов (например, глюкагона или адреналина), которые не могут проходить через клеточную мембрану.
цAMФ синтезируется аденилатциклазой в ответ на некоторые гормональные стимуляторы; действует как вторичный посредник при клеточном гормональном контроле путем стимуляции протеинкиназ. цАМФ является аллостерическим эффектором протеинкиназ A и ионных каналов. Синтезируется цАМФ мембранными аденилатциклазами (семейство ферментов, катализирующих реакцию циклизации АТФ с образованием цАМФ и неорганического пирофосфата). Расщепление цАМФ с образованием АМФ катализируется фосфодиэстеразами. Ингибируются цАМФ только при высоких концентрациях метилированных производных ксантина, например, кофеина. Аденилатциклазы активируются G-белками (активность которых в свою очередь зависит от метаботропных рецепторов, связанных с G-белками).
22. Под действием гликогенсинтазы образуется гликозидная связь ([1->4]-связь), но неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гли-когенветвящего фермента.
Гликогенсинтаза может находиться либо в фосфорилированном, либо в нефосфорилированном состоянии. Активна дефосфорилированная форма (гликогенсинтаза a), которая может быть инактивирована с образованием гликогенсинтазы b путем фосфорилирования семи остатков серина, осуществляемого не менее чем пятью различными протеинкиназа ми. Все семь мест фосфорилирования находятся на каждой из четырех идентичных субъединиц. Две из протеинкиназ являются Ca2+/ кальмодулин зависимыми. Одна из них - это киназа фосфорилазы, другая киназа является cAMP-зависимой протеинкиназой; именно эта протеинкиназа обеспечивает реализацию опосредованных cAMP гормональных воздействий, синхронно ингибирующих синтез гликогена и активацию гликогенолиз а. Оставшиеся киназы известны как киназы гликогенсинтазы -3, -4 и -5.
Фосфорилаза -фермент, который является катализатором в реакциях присоединения какой-либо органической молекулы (обычно глюкозы) к фосфатной группе (фосфорилирование) Фосфорилаза присутствует в печени и почках, где принимает участие в процессе расщепления гликогена до глюкозо-1 –фосфата.
Катализирует лимитирующую скорость гликогенолиза реакцию: фосфоролитическое расщепление (фосфоролиз) (1->4)-связей гликогена, продуктом является глюкозо-1-фосфат. Остатки глюкозы отщепляются от дальних концов молекулы гликогена (G6n) до тех пор, пока на ветвях, идущих от точки ветвления ([1->6]-связи), не останется примерно по 4 остатка глюкозы (такая молекула гликогена обозначена через G6ctn). n- число остатков глюкозы в молекуле гликогена.
30. Цикл превращения лимонной кислоты в живых клетках был открыт и изучен немецким биохимиком Хансом Кребсом, за эту работу он (совместно с Ф. Липманом) был удостоен Нобелевской премии (1953 год).
У эукариот все реакции цикла Кребса протекают внутри митохондрий, причём катализирующие их ферменты, кроме одного, находятся в свободном состоянии в митохондриальном матриксе, исключение составляет сукцинатдегидрогеназа, которая локализуется на внутренней митохондриальной мембране, встраиваясь в липидный бислой. У прокариот реакции цикла протекают в цитоплазме.
3 НАДН.Н+ дает 7.5 моль АТФ, 1 ФАДН2 дает 1.5 моль АТФ на дыхательной цепи. Кроме того в цикле путем субстратного фосфорилирования синтезируется 1 ГТФ, а затем из него синтезируется АТФ посредствам трансфосфорилирования: ГТФ + АДФ = АТФ + ГДФ
 2015-08-12
2015-08-12 2434
2434
