Переход от открытой формы моносахарида к циклической состоит из следующих этапов (на примере D-глюкозы):
1. Гидроксил, через который замыкается цикл циклической перестановкой помещают вниз проекции Фишера. 2. Замыкают цикл, при этом кислород гидроксила (помечен звездочкой) связывают с карбонильным углеродом (отмечен цифрой 1), а водород - с атомом кислорода карбонильной группы. 3. Строят циклическую формулу Фишера, при этом учитывают, что в форме вновь образовавшийся гидроксил (подчеркнут) находится с той же стороны от плоскости цикла (вертикальная линия в проекции Фишера), что и гидроксил, определяющий стерический ряд.
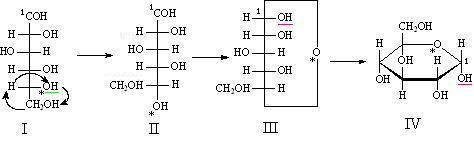
4. Переходят к проекции Хеуорса, Полученная циклическая форма будет называться: а-D-глюкопираноза
Фуранозные циклы: Основные этапы перехода от открытой формы к циклической те же, что и при построении пиранозного цикла, однако на первом этапе в перестановке участует радикал, содержащий хиральный центр (обведен красным). При переходе от проекции Фишера к проекции Хеуорса этот радикал поворачивают на 180о. Полученна: 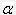 -D-глюкофураноза
-D-глюкофураноза
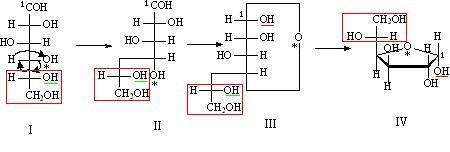
Пары Д., различающиеся конфигурацией одного из неск. асимметрич. атомов, наз. эпимерами, напр.:
Термин " аномеры " обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклич. форме, напр., аномерны -D- и -D-глюкозы. -Д., называемые также геом. изомерами, отличаются друг от друга разл. пространств. расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, напр., малеиновая и фумаровая к-ты.
Гликозидная связь — это тип функциональной группы, которая соединяет молекулу сахара с другой молекулой, часто с другим сахаром. Гликозидная связь образуется между полуацетальной группой сахара (или производной сахара) и гидроксильной группой органического соединения, например, спирта.
8. Олигосахариды(6) Лактоза - молочный сахар; важнейший дисахарид молока млекопитающих. В коровьем молоке содержится до 5% лактозы, в женском молоке - до 8%. В лактозе аномерная ОН-группа первого углеродного атома остатка D-галактозы связана β-гликозидной связью с четвёртым углеродным атомом D-глюкозы (β-1,4-связь). Поскольку аномерный атом углерода остатка глюкозы не участвует в образовании гликозидной связи, следовательно, лактоза относится к восстанавливающим сахарам.
Мальтоза поступает с продуктами, содержащими частично гидролизованный крахмал, например, солод, пиво. Мальтоза также образуется при расщеплении крахмала в кишечнике. Мальтоза состоит из двух остатков D-глюкозы, соединённых α-1,4-гликозидной связью.
Фруктоза является кетогексозой (кетогругша находится у второго углеродного атома). Фруктоза так же, как и глюкоза, существует в циклической форме, образуя α- и β-аномеры
9. ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ
Эпителиальные клетки кишечника способны всасывать только моносахариды. Поэтому процесс переваривания заключается в ферментативном гидролизе гликозидных связей в углеводах, имеющих олиго- или полисахаридное строение
А. Переваривание углеводов в ротовой полости В ротовой полости пища измельчается при пережёвывании, смачиваясь при этом слюной. Слюна на 99% состоит из воды и обычно имеет рН 6,8. В слюне присутствует фермент α-амилаза, расщепляющая в крахмале α-1,4-гликозидные связи. В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов - декстринов и небольшого количества мальтозы.
Действие амилазы слюны прекращается в кислой среде желудка. Желудочный сок не содержит ферментов, расщепляющих углеводы.
Б. Переваривание углеводов в кишечнике в тонком кишечнике в разных его отделах под действием гидролитических ферментов - гликозидаз.
Панкреатическая α-амилаза
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит бикарбонаты (НСО3-). С секретом поджелудочной железы в кишечник поступает панкреатическая α -амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе - дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями.
α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Целлюлоза проходит через кишечник неизменённой и выполняет функцию балластного вещества, придавая пище дополнительный объём и положительно влияя на процесс переваривания. в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО2.
Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала. Дисахариды сахароза и лактоза гидролизуются специфич дисахаридазами в тонком кишечнике.
Тонкий кишечник покрытых эпителиальными клетками, которые покрыты микроворсинками - щёточная каёмка.
Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс состоит из двух полипептидных цепей и имеет доменное строение. прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника. Способствует эффективному поглощению продуктов гидролиза клеткой.
гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6-гликозидные связи. α-1,4-гликозидные связи в мальтозе и мальтотриозе (трисахарид). На долю сахаразо-изомальтазного комплекса приходится 80% от всей мальтазной активности кишечника.
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза)
Лактаза расщепляет β-1,4-гликозидные связи между галактозой и глюкозой в лактозе.
гликопротеин. Лактоза связана с щёточной каемкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста.
Трегалаза - гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода
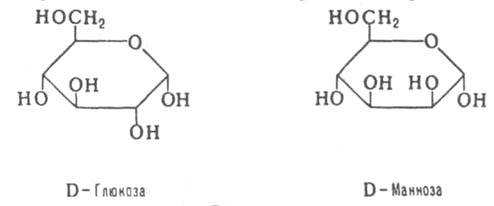
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых - глюкоза. также образуются фруктоза и галактоза, в меньшем количестве - манноза, ксилоза, арабиноза.
11. Гликолиз - это серия реакций, в результате которых глюкоза распадается на две молекулы пирувата (аэробный гликолиз) или две молекулы лактата (анаэробный гликолиз). Аэробный распад глюкозы включает реакции аэробного гликолиза и последующее окисление пирувата в реакциях катаболизма.
Таким образом, аэробный распад глюкозы - это предельное ее окисление до СО2 и Н2О, а анаэробный гликолиз - это специфический путь катаболизма, т. е. часть аэробного распада глюкозы. Анаэробный распад включает те же реакции специфического пути распада глюкозы до пирувата, но с последующим превращением пирувата в лактат (т. е. термины анаэробный распад и анаэробный гликолиз совпадают).
12. Гликолиз – это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях без потребления кислорода. Конечным продуктом является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:

В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода.
Процесс гликолиза катализируется 11 ферментами, протекает в гиалоплазме (цитозоле) клетки.
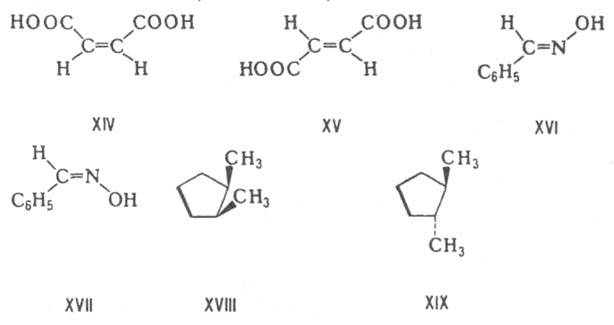
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Гексокиназа ингибирует глюкозо-6-фосфат, который и продукт реакции, и аллостерический ингибитор. Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани он отсутствует.
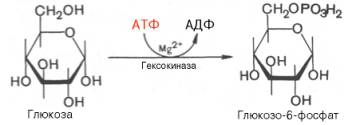
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:
протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
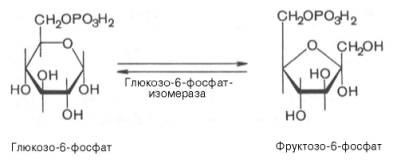
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулыАТФ:
практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
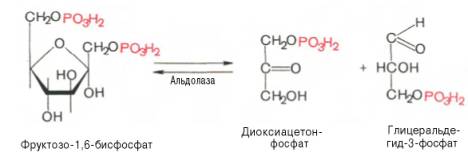
обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия – наиболее сложная и важная -окислительно-восстановительная (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:
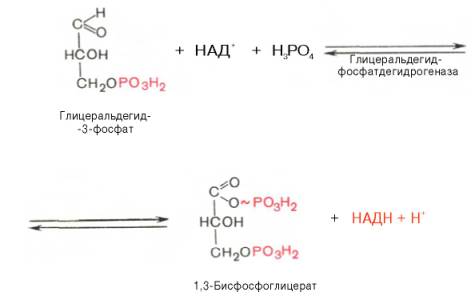
1,3- Бисфосфоглицерат -высокоэнергетическое соединение. Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
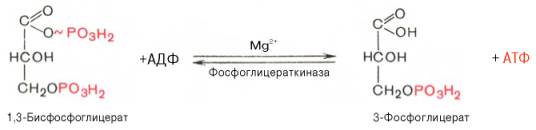
Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
легкообратима, протекает в присутствии Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2- фосфоглицериновая кислота в результате отщепления молекулыводы переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
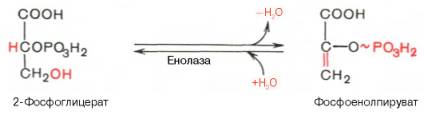
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
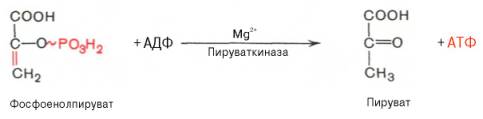
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

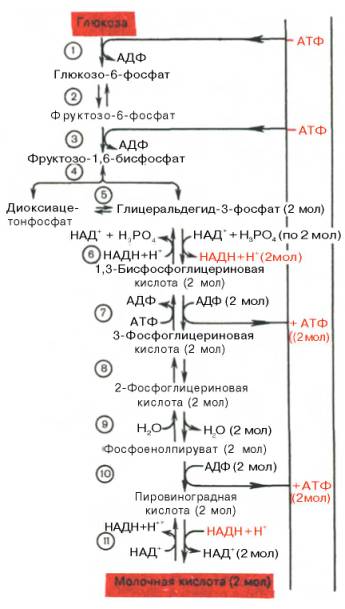
1 - гексокиназа; 2 - фосфоглюкоизоме-раза; 3 - фосфофруктокиназа; 4 - альдо-лаза; 5 - триозофосфатизомераза; 6 - гли-церальдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглице-ромутаза; 9 - енолаза; 10 - пируватки-наза; 11 - лактатдегидрогеназа.
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6 реакция) на пировиноградную кислоту (11 реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитический оксидоредукции.
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами.
13. Вторая стадия – наиболее сложная и важная -окислительно-восстановительная (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ (9и11ст)
16. Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H.
Полное уравнение гликолиза имеет вид:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+.
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
Глюкоза + 2АДФ + 2Фн = 2лактат + 2АТФ + 2H2O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания — окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, — дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
17. Распад гликогена (гликогенолиз) -биохимическая реакция, протекающая главным образом в печени и мышцах, во время которой гликоген расщепляется до глюкозы и глюкозо-6-фосфата.
происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы.
Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорг фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой.
Синтез и расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением её активного центра.
три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (р 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6- глюкозидазы в виде свободной глюкозы (р 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой.
перенос трёх остатков глюкозы и удаление мономера из точки ветвления (р 2 и 3) катализирует один и тот же фермент("деветвящим"), который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной.
Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы( фермент глюкозо-6-фосфатаза ), которая выделяется в кровь.
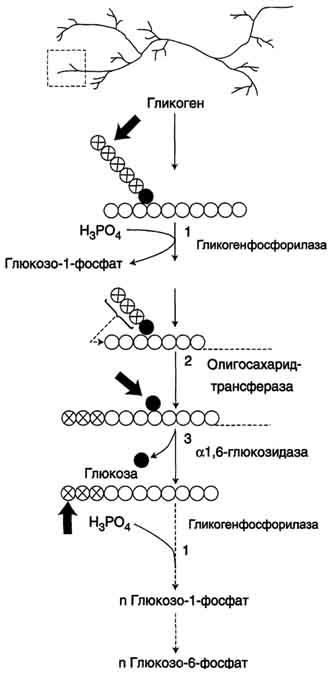
Распад гликогена. В рамке - фрагмент гликогена с точкой ветвления. Закрашенный кружок - глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки - глюкозные остатки в линейных участках и боковых ветвях, связанные α-1,4-гликозидной связью. 1 - Гликогенфосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза.
21. Синтез гликогена (гликогеногенез)
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). синтез гликогена из глюкозы (анаболический процесс)- эндергонический, т.е. требующим затрат энергии.
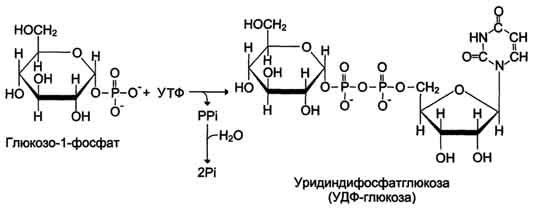
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (р 1). Затем глюкозо -6- фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (р2) под действием фермента фосфоглюкомутазы. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо -1- фосфата (р3) (Фермент УДФ-глюкопирофосфорилаза).
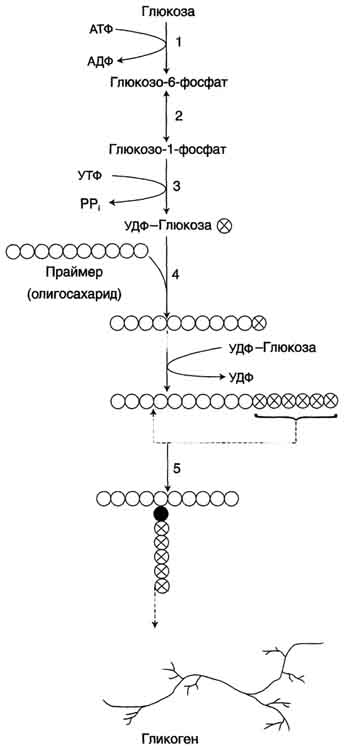
Синтез гликогена. 1 - глюкокиназа или гексокиназа; 2 - фосфоглюкомутаза; 3 - УДФ-глюкрпирофосфорилаза; 4 - гликогенсинтаза (глюкозилтрансфераза); 5 - фермент "ветвления" (амило-1,4 → 1,6-глюкозилтрансфераза), светлые и заштрихованные кружки - глюкозные остатки, закрашенные кружки - глюкозные остатки в точке ветвления.
 2015-08-12
2015-08-12 6354
6354








