Цель работы
Цель данной работы является практическое определение показателя политропы при истечении газа из сосуда в окружающую среду.
Краткие сведения из теории
Наименование данный процесс получил от сочетания двух греческих слов: «поли» - много и «тропос» - путь, т.е. политропный.
Соотношение термических параметров (P,V,T) в политропном процессе характеризуется следующими зависимостями:
PVn = const или 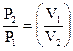 n; (11)
n; (11)
ТVn-1 = const или 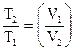 n-1; (12)
n-1; (12)
ТP(1-n)|n = const или 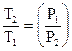 (1-n)/n; (13)
(1-n)/n; (13)
где Р – абсолютное давление, Н2/м; V – удельный объем, м3/кг; Т – абсолютная температура, К; n – показатель политропы n в конкретном термодинамическом процессе может иметь любое значение в пределах от – ∞ до +∞, оставаясь постоянным); СV,CP и С удельная (массовая) теплоемкость в процессе соответственно изохорном, изобарном и политропном, Дж/(кг×К).
Удельная теплоемкость в политропном процессе зависит от показателя политропы и может быть определена из формулы,
h=(C-CP)/(C-CV), преобразовав которую получим:
C=CV 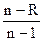 , (14)
, (14)
где R – показатель адиабаты,
К = μСЗ.μСМ = СЗ.СМ (15)
μCP и μCV - удельная (киломольная) теплоемкость газа в процессе соответственно изобарном и изохорном, Дж/(кмоль×К).
Численное значение показателя адиабаты R для газов различной атомности можно определить по формуле (15), если использовать данные табл.2.
Как следует из табл. 2, разность μCP-μCV для газов различной атомности имеет одно и то же значение, которое равно 8314 Дж/(кмоль×К). Эта разность обозначается через μR и называется универсальной газовой постоянной, а выражение
μCP - μCV = μR (16)
или CP - CV = R
известно, как уравнение Майера.
Здесь R= μR/μ – газовая постоянная, Дж/ (кг×К).
Таблица 2
Киломольная теплоемкость при P = const и V = const и значения показателя адиабаты для газов различной атомности
| Атомность газа | Газы | μCV | μCP | R | ||
| ккал/кмоль×К | кДж/кмоль×К | ккал/кмоль×К | кДж/кмоль×К | |||
| Одно-атомный | Не Ar | ~3 | ~12,6 | ~5 | ~20,9 | ~1,67 |
| Двух-атомный | H2 O2 N2 CO | ~5 | ~20,9 | ~7 | ~29,3 | ~1,4 |
| Трех- и более атомный | CO2 H2O CH4 NH3 | ~7 | ~29,3 | ~9 | ~37,7 | ~1,29 |
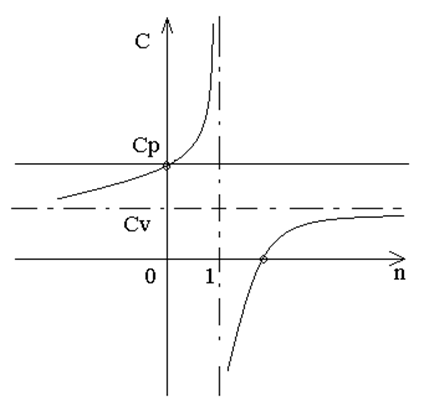
Рис.3. Зависимость удельной теплоемкости от показателя политропы
Графическая зависимость удельной теплоемкости от показателя политропы приведена на рис. 3, откуда следует, что теплоемкость С в политропном процессе при k > n >1 имеет отрицательное значение. Следовательно в процессах, протекающих при данном значении показателя политропы, dg и dT имеют различные алгебраические знаки. Иными словами, если к рабочему телу в процессе при k > n >1 подводится теплота, то его температура снижается, а при отводе теплоты – повышается. (Разбираемый ниже пример подтверждает данное положение).
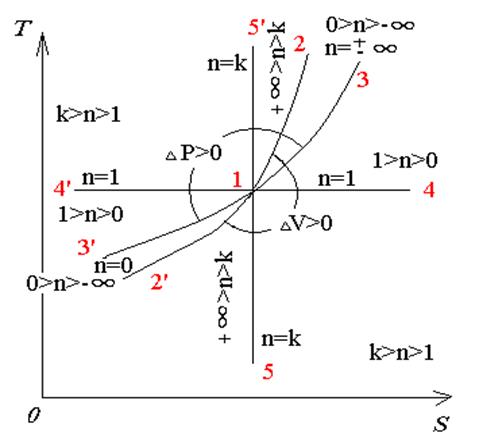
Расположение политроп в pV и Ts – координатах при различных значениях показателя политропы n, приведено на рис. 4, из которого видно, что политропный процесс изменения состояния газа по отношению к частным термодинамическим процессам (изохорному, изобарному, изотермному и адиабатному) является обобщающим.
Действительно, если в уравнении (11) принять:
n= 0, получим уравнение изобары (p =const);
n=1, получим уравнение изотермы(pV =const).
n=k, получим уравнение адиабаты (pV R=const);
n=±∞, получим уравнение изохоры (V =const).
Удельная теплоемкость частных термодинамических процессов может быть определена по рис. 1 или из формулы (13); при n= 0 (изобарный процесс) удельная теплоемкость Ср;
>> n =1 (изотермный процесс) >> C т=±∞;
>> n = k (адиабатный процесс) >> Cs =±∞;
>> n =±∞ (изохорный процесс) >> Cv =±∞.
Пользуясь одной из диаграмм (рис.2) можно определить как в конкретном процессе при расширении или сжатии газа и известном показателе политропы изменяется давление газа, его объем, температура, внутренняя энергия и энтропия, а также производится или отводится процессе от газа теплота. Так, например, из практики известно, что сжатие воздуха (двухатомный газ) в компрессоре, цилиндр, которого оборудован охлаждающей водяной рубашкой, осуществляется при показателе политропы n ≈1,35.
В этом случае политропа сжатия воздуха (значение k для которого = 1,41) располагается между изотермой 1-4’ и адиабатной 1-5’ и k > n >1 (см. рис. 2), что можно было бы определить и логически.
Теоретически возможны два крайних случая процесса сжатия газа в компрессоре:
1. Выделяющаяся при сжатии газа теплота полностью отводится во внешнюю среду, и температура сжимаемого газа остается неизменной – изотермическое сжатие.
(Изотермическое сжатие возможно в том случае, когда процесс происходит бесконечно длительное время, при котором разность температур между сжигаемым газом и внешней средой dT =0).
2. Сжатие газа производится в цилиндре, стенки которого являются

a)
б)
Рис. 4. Области возможных политропных процессов (а) PY и TS (б) диаграммах
абсолютным теплоизолятором, и теплота, выделяющаяся при сжатии газа, полностью расходуется на нагрев сжимаемого газа (случай азиабатного сжатия).
В реальном компрессоре сжатие газа происходит за конечный (довольно небольшой) промежуток времени; стенки цилиндра компрессора выполняются из теплопроводного материала (охлаждаемого с внешней стороны водой). Поэтому в реальном компрессоре, чхотя и происходит теплообмен между сжатымнагревшимся газом и охлаждающей водой, в следствии быстро протекающего процесса сжатия он до конца пройти не успевает. При этом изменяются не только термические параметры T, p и V, но и энтропия газа S, т.е. наблюдается политропный процесс сжатия, который располагается между изотермным и адиабатным.
Пользуясь диаграммами (рис.2), определим, как изменяются в данном процессе интересующие нас величины:
1) объем газа уменьшается – (Δ V <0);
2) работа сжатия газа – отрицательная (L << - >>), что следует из формулы Δ L = p Δ V;
3) температура сжимаемого газа увеличивается – (Δ Т >0);
4) внутренняя энергия газа (Δ U >0) увеличивается, т.к. Δ U = c Δ T;
5) давление газа, сжимаемого в компрессоре, возрастает (Δ Р >0);
6) энтропия газа уменьшается (Δ S <0), поскольку его сжатие ведется с отводом теплоты (Δ q <0 или q << - >>), а энтропия и теплота связаны соотношением dS=dq/T;
7) значение показателя политропы «n» находится в пределах k > n >1.
Удельная работа, Дж/кг, расширения газа в политропном процессе может быть определена по одной из следующих формул:
Lnn =1/(n -1)×(p 1 V 1- p 2 V 2)= R /(n -1)×(T 1- T 2)= RT 1/(n -1)×(1- T 2/ T 1)=
p 1 V p 1 V 1
= ———[1- (V 1/ V 2) n -1 ]= ———[1- (P 2/ P 1) (n -1)/ n ] (17)
n -1 n -1
Удельная теплота, Дж/кг, политропного процесса
q = c (T 2- T 1) = cV (n-k)/(n -1) × (T 2- T 1) (18)
и изменение энтропии газа, Дж/(кг×К),
(S 2- S 1) = cV (n-k)/(n -1) ln T 2/ T 1 (19)
Для определения показателя политропы n в каком-либо реальном процессе имеются достаточно простые способы. Так, если располагаем индикаторной диаграммой процесса (см. рис. 2,а), то для определения среднего значения n, например в процессе 1-6, используется уравнение (10) для двух точек, в которых значение параметров p и V известно:
p 1 V 1n= p 6 V 6 n
После логарифмирования имеем
lg p 1+ n lg V 1= lg p 6+ n lg V 6
откуда
lg p 6 - lg p 1
n = —————, (20)
lg V 1- lg V 6
Порядок выполнения лабораторной работы
Определение показателя политропы n для воздуха при его расширении проводится на лабораторной установке в такой последовательности (рис. 5):
С помощью вентилятора в баллон 1 при открытом кране 2 нагнетается воздух.
2. После создания внутри баллона избыточного давления Р м1=1000 Н/м2 кран 2 закрывают, а вентилятор отсоединяют от нагнетательного патрубка.
3. Поскольку температура нагнетаемого воздуха в результате его сжатия окажется несколько выше температуры окружающей сред, то для устранения этой разности делают некоторую выдержку (не менее пяти минут). При этом имеет место изохорный процесс – снижение температуры воздуха внутри баллона, имеющего постоянный объем. Для изохорного процесса соотношение термических параметров р и Т выражается уравнением
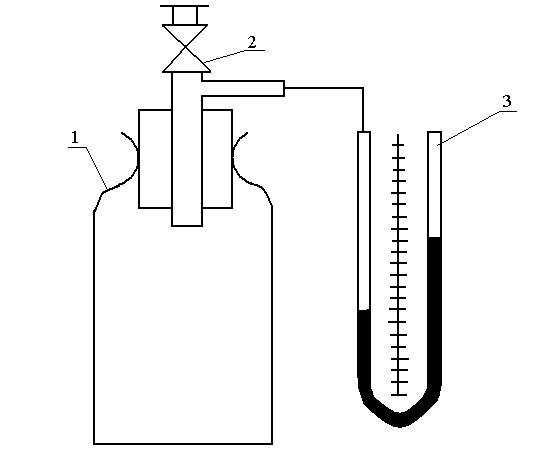
Рис. 5. Схема лабораторной установки к работе 2:
1 – стеклянный сосуд; 2 – пропковый запорный кран; 3 – образный жидкостный манометр
Т 2 / Т 1 = Р 2 / Р 1 (21)
О моменте выравнивания температуры сжатого в баллоне воздуха с температурой окружающей среды сулят по окончанию измерения давление внутри сосуда, которое определяется с помощью U – образного манометра 3. Избыточное давление сжатого воздуха при этом несколько снижается с Р м1 до Р 3.
4. Открывают кран 2. В результате расширения газа давление в баллоне падает до атмосферного. При этом температура воздуха, находящегося в баллоне, снижается. Снижение температуры газа при его расширении обусловлено тем, что работа расширения совершается за счет внутренней энергии, т.е. ее уменьшения. Внутренняя энергия газа с его температурой связана соотношением U=cvT.
5. Кран 2 закрывают. Затем производят выдержку (не менее пяти минут) с целью выравнивания температуры воздуха в баллоне с температурой наружной среды. При этом в баллоне протекает изотермический процесс (при подводе теплоты из внешней среды к воздуху, находящемуся в баллоне).
О моменте выравнивания температуры газа в баллоне и наружного воздуха судят по окончанию измерения внутри баллона давления, определяемого с помощью U – образного манометра.
Абсолютное давление Р 3 в баллоне становится больше атмосферного Р б на величину Р м3.
Показатель политропы для исследуемого газа в политропном процессе подсчитывается исходя из следующих соображений.
В результате адиабатного расширения газа соотношение термических параметров Т и Р выразится уравнением (12).
Т 2 / Т 1 = (Р 2 / Р 1)( n -1)/ n (22)
Вслед за адиабатным процессом расширения следует изохорный процесс нагревания газа, для которого согласно (20), соотношение параметров Т и Р выразится уравнением
Т 2 / Т 3 = (Р 2 / Р 3) (23)
Однако по условию опыта Т1=Т3 =Токр, следовательно имеем
Р 2 / Р 3 = (Р 2 / Р 1)(n -1)/ n или(Р / Р 1)(n -1)/ n = Р б / Р 3 (24)
Пролагорифмируем последнее выражение:
(n -1)/ n lg (Р б / Р 1)= lg(Р б / Р 3 ),
или
n lg (Р б / Р 1) - n lg (Р б / Р 3)= lg(Р б / Р 1 ),
откуда
lg Р 1 - lg Р б
n = −−−−−−−−−−, (25)
lg Р 1 - lg Р 3
где Р 1 = Р б + Р м1; Р б- барометрическое давление в момент опыта; Р м1- избыточное (манометрическое) давление газа в баллоне перед его расширением; Р 3 = Р б + Р м3; Р м3 - избыточное (манометрическое) давление газа в баллоне после его расширения и последующего за ним изохорного нагревания.
По указанию руководителя величины Р1, Рб и Р3 в формуле (25) подставляют в одной из следующих единиц измерения: Н/м2; мм вод.ст. (кгс/м2); мм рт ст и др.
В отчете по лабораторной работе следует привести следующие данные:
1.) цель и порядок выполнения работы;
2.) схему лабораторной установки;
3.) результаты опытных данных, сведенные в таблице 5;
4.) изображение процесса изменения состояния газа в эксперименте в p v Ts – координатах и его сравнение с изохорным, изобарным, изотермным и адиабатным.
Таблица 5
| Данные опыта | Индекс | Размерность | Величина |
| Барометрическое давление в момент опыта | Рб | ||
| Избыточное (манометрическое) давление в баллоне перед расширением газа | Рм1 | ||
| Абсолютное давление в баллоне перед расширением газа | Р1 | ||
| Избыточное (манометрическое) давление в баллоне после расширения газа и его изохорного нагревания | Рм2 | ||
| Абсолютное давление в баллоне перед расширением газа и его изохорного нагревания | Р3 | ||
| Показатель адиабаты исследуемого газа | k | ||
| Показатель политропы, полученный в опыте | n |
Контрольные вопросы
1. Порядок выполнения лабораторной работы.
2. Термодинамические (политропные и частные) процессы, наблюдаемые в природе и технике.
3. Соотношение термических параметров в политропном процессе.
4. Теплоемкость политропного и частных термодинамических процессов.
5. Соотношение удельных теплоемкостей изобарного и изохорного процессов (уравнение Майера и показатель адиабаты).
6. Изображение политропных процессов в pv и Ts - координатах и сравнение их с частными термодинамическими процессами.
7. Определение показателя политропы по индикаторной диаграмме процесса.
Литература
/4/, с. 25-55; /5/, с. 57-58.
 2015-08-21
2015-08-21 6811
6811
