Цель работы
Цель данной лабораторной работы – наглядно убедиться в том, что при горячей обработке стальных изделий без надлежащей их защиты от окисления происходит значительная потеря металла.
Краткие сведения из теории
В составе печной газовой среды, в которой проводится нагрев стальных изделий, могут присутствовать несколько компонентов, по-разному взаимодействующих с обрабатываемым металлом. Одни газы, входящие в состав печной атмосферы, являются восстановительными по отношению к железу и легирующим элементам стали, другие – окислительными. Имеются компоненты, которые науглероживают или обезуглероживают обрабатываемые стали. И, наконец, есть инертные газы, которые при температурах горячей обработки не вступают во взаимодействие ни с железом и легирующими элементами, ни с углеродом, находящимся в стали.
Исходя из этих соображений, компоненты печных сред разбивают на отдельные группы по характеру их взаимодействия со сталью (см. табл.)
При горячей обработке стальных изделий в воздушной среде продуктов полного сгорания топлива неизбежног их окисление и обезуглероживание.
Окисление – это процесс взаимодействия железа и легирующих элементов стали с кислородом воздуха (в электрических печах) или с продуктами сгорания (в пламенных печах), которое приводит к потерям металла (угару) в результате его превращения в окалину.
Таблица 2
Классификация компонентов печных атмосфер по действию
на сталь при t>Ac1
| Действие на сталь | Название газа и химическая формула | |
| окисляющее | Сернистый ангидрид Кислород Двуокись углерода Водяной пар | SO2 O2 CO2 H2O |
| восстанавливающее | Водород Окись углерода Метан | H2 CO CH4 |
| обезуглероживающее | Кислород Двуокись углерода Водяной пар Водород | O2 CO2 H2O H2 |
| науглероживающее | Метан Окись углерода | CH4 CO |
| Продолжение табл. 2 | ||
| инертное | Азот Аргон Гелий | N2 Ar He |
Величина угара металла зависит от многих причин,к важнейшим из которых относятся: состав газовой среды, температура и продолжительность нагрева, а также состав обрабатываемой стали и форма изделия.
Окислительные газы, которые могут присутствовать в печной атмосфере, по степени уменьшения их окислительной способности можно поставить в следующем порядке:
SO2-O2-Н2O-CO2 *)
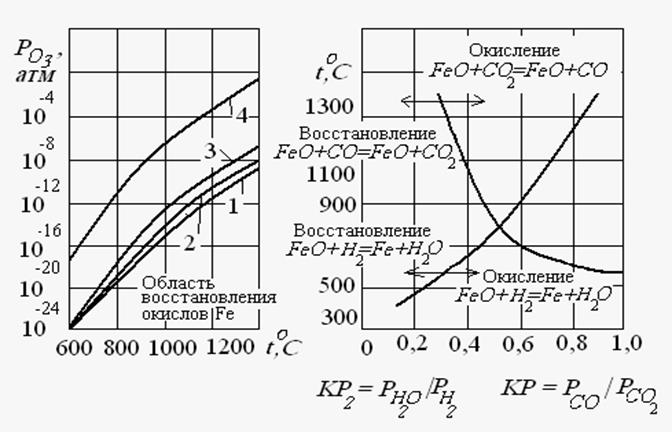
| Рис. 6 Упругость диссоциации окислов железа для реакций: 1 – 2 Fe + O2=2FeO 2 – 3 Fe + 2O2=Fe3O4 3 – 4 Fe3O4 + O2=6 Fe2O3 | Рис. 7. Кривые равновесия реакций Fe + H2O = FeO +H2, FeО + CO= Fe +CO2 |
____________________________________
*) При безокислительном нагреве наличие в составе печной атмосферы является абсолютно недопустимым, поскольку на поверхности стали образуются легкоплавкие окислы и сульфиды железа, ускоряющие процесс окисления
Характерными реакциями окисления являются:
2Fe + O2 = FeO, (26) Fe + H2O = FeO +H2, (27)
Fe + CO2 = FeO +CO. (28)
Реакция (26) в интервале температур горячей обработки протекает слева направо, т.е. в сторону окисления Fe. И только при более высоких температурах и ничтожно малых концентрациях кислорода возможно восстановление окислов Fe в зависимости от температуры (рис. 6) иллюстрируют данное положение.
Анализируя диаграмму, можно заключить, что при безокислительной термообработке присутствие кислорода в свободном состоянии в печной атмосфере (так же, как и SO2) недопустимо.
Кривые равновесия реакций (27) и (28) в зависимости от температуры приведены на рис. 7, из них следует:
1. С повышением температуры окислительная способность водяных паров (при неизменном соотношении РН20/ РН2) уменьшается. Придальнейшем повышении температуры область окисления сменяется областью восстановления, причем чем выше температура, тем выше восстановительные свойства атмосферы типа H2 - H2O по отношению к железу.
2. В противоположность к сказанному, окислительная способность двуокиси углерода (по отношению к железу) с повышением температуры возрастает. В этом случае область окисления железа (при неизменном соотношении РС02/ РСО) сменяется областью восстановления с понижением температуры.
При нагреве стальных изделий в пламенных печах построение кривой равновесия газовой среды с Fe весьма затруднительно, так как состав этой среды является сложным.
Для продуктов реакции водяного газа
CO2 + Н2O <=> CO + Н2O (29)
Такая кривая приведена на рис. 11*.
Окисление изделий при их горячей обработке отрицательно сказывается на технико-экономических показателях производства – происходит безвозвратная потеря металла вследствие его перехода в окалину; качество поверхности изделия ухудшается и, кроме того, необходима дополнительная операция по очистке изделий от окалины. При каждом нагреве изделий под термообработку без защиты их от окисления угар 1 ÷ 2% считается нормальным. В кузнечных же печах потери металла в окалину при каждом нагреве достигают 5%.
*) При построении кривой не учтено взаимодействие атмосферы с углеродом стали, а также наличие в стали легирующих элементов
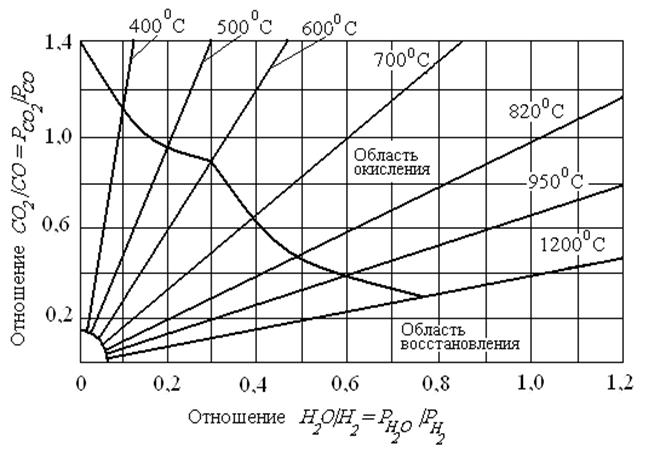
Рис. 8. Кривая равновесия реакции водяного газа (CO2 + Н2O <=> CO + Н2O) с железом
Окисление железа в воздушной среде заметно уже при t ≈160 ºC в виде появления так называемых «цветов побежалости». При этом на поверхности металла появляется тонкий (толщиной в тысячные доли миллиметра) слой окисла Fe2O3; величины поверхности их торцов по отношению к боковой поверхности могут при одних и тех же условиях нагрева дать больший угар, чем заготовки длинные.
Практическими характеристиками окисления являются – массовый и поверхностный угар, скорость окисления и толщина слоя окалины.
Массовый угар – отношение количества металла, окисленного в процессе нагрева, к исходному количеству мет Алла, выражаемое в процентах.
Поверхностный угар – количество окисленного металла, отнесенное к единице поверхности нагреваемого изделия и выражаемое в кг/м2.
Отношение поверхностного угара к времени нагрева называется скоростью окисления. Толщина слоя окалины S с поверхностным угаром связана соотношением
S=a /ρ k (30)
где S – толщина слоя окалины, м; a - поверхностный угар, кг/м2; ρ- плотность окалины (можно принять равной 4000 кг/м3); k - среднее содержание железа в окалине, которое колеблется в пределах 0,715 +0,765 кг/кг.
Обезуглероживание – это процесс взаимодействия печной атмосферы с углеродом стали, находящимся в твердом растворе, сопровождающийся обеднением углерода в поверхностных слоях обрабатываемых изделий.
На характер обезуглероживания влияют многие факторы, основными из которых являются: состав печной атмосферы, марка обрабатываемой стали, температура и время процесса.
По степени уменьшения обезуглероживающего воздействия на углеродистые и малолегированные стали газы располагаются в следующем порядке:
H2 вл.....Н2О.......СО2........N2техн......Н2сух......N2
Характерные реакции обезуглероживания:
2С(вγ-Fe) + О2 ó 2СО (31)
С(вγ-Fe) + H2O ó СO + H2 (32)
С(вγ-Fe) + СО2 ó 2СO (33)
2С(вγ-Fe) + 2H2 ó 2СH4 (34)
Наиболее полно исследовано взаимодействие углерода обрабатываемых сталей с газовыми смесями: Н2 – СО – Н2О; СО – СО2 и Н2 – СН4. Из них следует, что термодинамическая активность взаимодействия водяных паров и двуокиси углерода углеродом стали с повышением температуры возрастает, а обезуглероживающая способность водорода резко снижается.
Принято считать, что видимое обезуглероживание происходит только в том случае, ксли сталь обрабатывается в аустенитном состоянии, т.е. при t > A c1. В действительности наблюдаются случаи обезуглероживания и при температурах около или несколько ниже 700 С (большей частью в атмосфере, богатой водородом).
Низкотемпературное обезуглероживание протекает очень медленно и может быть обнаружено только при длительных технологических процессах, например, при отжиге сталей на зернистый перлит, причем поверхностный обезуглероженный слой часто является чисто ферритным.
Обработка в обезуглероживающей газовой среде трансформаторной стали, ферросплавов, а также изделий, подвергаемых эмалированию – это те случаи, когда обезуглероживание действительно необходимо. При термообработке же деталей машин и инструмента обезуглероживание приводит к снижению их механических свойств и тем сильнее, чем выше содержание углерода в стали и чем на большую прочность она обработана.
Чтобы придать требуемые механические свойства по всему сечению обрабатываемой детали, необходимо полностью удалить обезуглероженный слой (до 2 мм). Трудоемкость изготовления изделия при этом резко возрастает, что отрицательно сказывается в конечном итоге, на технико-экономических показателях производства.
Глубину обезуглероженного слоя можно определить по изменению твердости на скошенной поверхности закаленного образца, проведением химического анализа последовательно срезаемых слоев и по анализу микроструктуры. Степень обезуглероживания выявляют также по снижению массы обрабатываемых образцов.
Методы борьбы с окислением и обезуглероживанием
Применяемые в производстве методы борьбы с окислением и обезуглероживанием можно разделить на две группы. К первой относятся различные передовые приемы обслуживания эксплуатации нагревательных печей, к которым относятся – улучшение условий сжигания топлива и автоматизация тепловых процессов, скоростные и ускоренные во времени режимы нагрева металла. Эффект применения методов первой группы, однако, невелик – потери металла за счет окисления могут быть уменьшены лишь вдвое. Что касается защиты от обезуглероживания, а также очистки изделий после их горячей обработки от окалины, то эти вопросы в данном случае остаются нерешенными.
Ко второй группе методов борьбы с окислением и обезуглероживанием относят нагрев в печах, где исключается контакт обрабатываемой стали с окисляющими и обезуглероживающими газами. К таким печам можно отнести соляные и металлические ванные, а также печи, где нагрев ведется в контролируемой (защитной) атмосфере. В печах, где используются контролируемые атмосферы, недопустимо попадание воздуха или продуктов сгорания топлива в рабочее пространство печи. Поэтому либо нагреваемый металл (омываемый защитным газом) изолируется от окисляющих и обезуглероживающих газов в герметическом муфеле, либо спмо пламя изолируется от камеры печи – сжигания топлива в этом случае ведут внутри труб, называемых радиационными.
Контролируемые атмосферы (КА) – это специально приготовленные (обычно вне печи) газовые смеси, которые при температурах горячей обработки являются восстановительными к железу и легирующим элементам, и часто нейтральными по отношению к углероду, находящемуся в стали.
Для приготовления КА требуемого состава в принципе может быть использовано различное сырье – твердое, жидкое или газообразное. В существующих газоприготовительных установках сырьем для получения КА различного типа в большинстве случаев является природный газ и реже – аммиак, а в качестве окислителей – воздух или технический азот.
Применение при горячей обработке металлов КА позволяет значительно повысить качество и снизить себестоимость выпускаемой продукции. Использование КА способствует устранению обезуглероживания обрабатываемых изделий, а также потерь металла на угар, трудоемких и вредных для рабочих очистных операций.
Порядок выполнения лабораторной работы
При выполнении лабораторной работы необходимо соблюдать правила техники безопасности (см. приложение 2).
Установка состоит из электрической нагревательной печи и термопары с милливольтметром.
Печь перед опытом разогревается до требуемой температуры при которой определяются потери металла от окисления. Для получения средней температуры в течение опыта температура печи фиксируется каждые 3 минуты. Определение угара производится на трех образцах, каждый из которых находится в печи соответственно 15, 30 и 45 минут или 20, 40 и 60 минут (по указанию преподавателя). Перед опытом и по окончании его, после удаления окалины, образцы взвешиваются на аналитических весах с точностью до 10-4 г. Перед опытом снимаются размеры каждого образца. Чтобы исключить дополнительное окисление при охлаждении, образцы охлаждают в воде. После проведения опыта определяют массовый угар f, % поверхностный угар а, кг/м2, и скорость окисления ω, кг/(м 2 ·ч):
G 1- G 2
f = ―――× 100%, (35)
G 1
где G 1 – масса образца до нагрева, кг; G 2 - масса образца после нагрева и очистки окалины, кг;
G 1- G 2
а = ―――, (36)
F
где F - боковая поверхность образца, м2;
G 1- G 2
ω= ―――, (37)
F τ
где τ – время нагрева образца, ч.
Результаты измерений и расчетов заносятся в таблицу 5.
Таблица 5
Результаты экспериментов и расчетов
| № об-раз- цов | Масса образца, кг | Боко-вая по-верх-ность образ-ца, м2 | Сред-няя тем- пера-тура печи, °С | Продол-житель-ность нагрева, мин | Мас- са об-разца после нагре-ва, кг | Массо-вый угар, f % | Поверх-ност-ный угар кг/м2 | Ско-рость окис-ления, кг/(м2·ч) |
Опыты проводятся с тремя образцами (влияние продолжительности нагрева) при двух разных температурах разогрева печи. По результатам экспериментов строятся зависимости массового и поверхностного угара и скорости окисления от времени и температуры нагрева.
Отчет по работе должен включать:
- цель работы;
- табл. 7 с результатами экспериментов и расчетов;
- необходимые расчетные выражения;
- зависимости массового угара, поверхностного и скорости окисления от времени и температуры нагрева.
Контрольные вопросы
1. Процесс окисления железа. Состав окалины.
2. Количественная характеристика угара.
3. Влияние на величину угара температуры печи, продолжительности нагрева, состава печной атмосферы, формы заготовки.
5. Меры борьбы с угаром и обезуглероживанием.
Литература
/ 6 /, с.38-92; / 7 /, с.5-12; 27-31.
Список литературы
1. Исаченко В.П., Осипова В.А., Сукомея А.С. Теплоотдача. – М.: Энергия. 1975. 488 с.
2. Боришанский В.М., Кутателадзе С.С., Новиков И.И., Федынский О.С. Жидкометаллургические теплоносители. – М.: Атомиздат, 1976. 328 с.
3. Кутателадзе С.С. Теплопередача и гидравлическое сопротивление: справочное пособие. – М.: Энергоатом издат, 1990. 367 с.
4. Юдаев Б.Н. Техническая термодинамика. Теплопередача: Учебник для вузов. – М.: Высшая школа, 1988. 479 с.
5. Титов Н.А. Сборник лабораторных задач по газопечной и металлургической теплотехнике / ГПИ. Горький, 1974. 59 с.
6. Ващенко А.И. Зеньковский В.Г., Лившиц А.Е., Шульц А.А. Окисление и обезуглероживание стали. – М.: Металлургия, 1972. 336 с.
7. Титов Н.А. Контролируемые атмосферы в термическом производстве / ГПИ. Горький, 1981. 84 с.
 2015-08-21
2015-08-21 3306
3306








