Гетерогенные системы состоят из непрерывной (сплошной) среды и дискретной фазы, включающей один или более компонентов. Примеры таких систем приведены в таблице 5.2 (Г – газ; Ж – жидкость; Т – твердое вещество).
В гетерогенной системе областью химического взаимодействия являются поверхности раздела фаз.
Таблица 5.2
Примеры гетерогенных систем
| Дисперсная фаза – дисперсионная среда | Тип систем | Примеры |
| Т–Ж | Золи, суспензии, взвеси | Золи металлов, гидровзвеси |
| Ж–Ж | Эмульсии | Технологические эмульсии, смазки |
| Г–Ж | Пены, газовые эмульсии | Пены, барботажный слой, кипящая и кавитирующая жидкость |
| Т–Т | Твердые коллоиды | Сплавы |
| Ж–Т | Пористые тела, капиллярные системы | Адсорбенты, влажные тела, иониты, фильтрующие слои |
| Г–Т | Пористые и капиллярные системы | Силикагель, активные угли, цеолиты, катализаторы, мембраны, фильтры |
| Т–Г | Аэрозоли, взвеси | Дымы, псевдоожиженный слой |
| Ж–Г | Аэрозоли | Туманы, капельные выбросы |
| Г–Г | Неоднородные газы | Расслаивающиеся газы |
Скорость гетерогенной реакции является сложной функцией параметров нескольких процессов, протекающих параллельно: массопередачи извне в реакционную среду, собственно химической реакции и выведения продуктов процесса из реакционного пространства.
Элементарные стадии химической реакции протекают с разной скоростью. При этом в условиях стационарного процесса скорости всех стадий будут одинаковы и равны скорости самой медленной стадии. Эту стадию называют лимитирующей. Поэтому их интенсификация связана с ускорением лимитирующей стадии.
Для решения данной проблемы в теорию гетерогенных процессов введено понятие области протекания реакции. По этой теории, гетерогенная реакция может протекать в кинетической, диффузионной или переходной (диффузионно-кинетической) областях. Название этих областей связано непосредственно с лимитирующей стадией. Если лимитирующей стадией является химическое превращение, то говорят о кинетической области протекания процесса. К числу кинетических факторов относят температуру, давление, концентрацию реагентов и катализатора, природу и активность последнего и другие. Если лимитирующей стадией является скорость массопередачи, то реакция протекает в диффузионной области. Известно, что для процессов, протекающих в этой области, скорость пропорциональна площади границы раздела фаз и движущей силе процесса (изменению концентрации), под действием которой происходит массопередача (5.32):
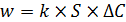 , (5.32)
, (5.32)
где k – коэффициент пропорциональности,
S – площадь поверхности раздела фаз,
D C – градиент концентрации.
Из уравнения (5.32) следует, что скорость процесса можно повысить, увеличив площадь соприкосновения фаз. Эта цель достигается измельчением твердого реагента и развития его внутренней структуры (пористости). В системах с участием жидких веществ для увеличения поверхности контакта применяют такие приемы, как использование насадочных устройств, барботаж, пенный слой. Значение константы скорости определяется соотношением (5.33):
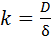 , (5.33)
, (5.33)
где D – коэффициент диффузии,
d– толщина диффузионного пограничного слоя.
С повышением температуры коэффициент диффузии возрастает, но в значительно меньшей степени, чем скорость химической реакции. Тем не менее, температурный фактор часто используется для повышения скорости диффузионных процессов. Более эффективным является прием интенсификации путём перемешивания контактирующих фаз. Этим достигается уменьшение толщины диффузионного слоя, что приводит к резкому увеличению константы скорости процесса массопередачи.
Для увеличения движущей силы процессов массопередачи D С используют следующие приемы:
– повышение концентрации компонентов сырья;
– удаление продуктов процесса из реакционной зоны;
– смещение равновесия в направлении, повышающем градиент концентрации D С.
Таким образом, к диффузионным факторам, определяющим интенсивность процессов массопередачи, можно отнести линейные скорости движения фаз, число оборотов перемешивающих устройств, характеристики границы раздела фаз. Поскольку диффузионные факторы во многом определяются гидродинамикой потоков, то их часто называют гидродинамическими. Если скорости массопередачи и реакции соизмеримы, то говорят, что процесс протекает в переходной области.
Проведение реакции в кинетической области (отсутствует диффузионное торможение) наиболее предпочтительно с точки зрения кинетики, однако ряд промышленных процессов реально осуществляют в диффузионной области. Это касается, прежде всего, высокотемпературных процессов, когда трудно избежать диффузионных торможений по причине высоких скоростей химических реакций.
Равновесие гетерогенных процессов определяется константой равновесия химических реакций, законом распределения компонентов между фазами и правилом фаз. Равновесие между исходными реагентами и продуктами химической реакции, происходящей в одной из фаз, определяется константой равновесия так же, как и для гомогенных процессов. При расчёте и моделировании гетерогенных процессов степень приближения к равновесию характеризуется критерием равновесия. Равновесные концентрации компонентов в соприкасающихся фазах определяются законом распределения вещества, который устанавливает постоянное соотношение между равновесными концентрациями вещества в двух фазах системы при определённой температуре. Постоянство соотношения не нарушается при изменении начальной концентрации компонента или общего давления в системе.
Скорость превращения в гетерогенном химическом процессе, выраженная через условия процесса, есть наблюдаемая скорость превращения.
Скорость отдельного процесса (реакции, массопереноса) определяется величиной его параметра (константы скорости, коэффициента массообмена) и движущей силы (концентрации для реакции, разность концентраций для массопереноса). Параметр процесса – характеристика его интенсивности. В многостадийном процессе возможны разные соотношения параметров его стадий.
Наблюдаемая скорость реакции зависит от константы скорости реакции k и коэффициента массообмена β.
Если k << β, то есть реакция малоинтенсивна, то наблюдаемая скорость превращения равна скорости реакции и не зависит от параметров переноса. Процесс протекает в кинетическом режиме, а реакция является лимитирующей стадией.
В случае k >> β интенсивность массообмена мала и скорость превращения не зависит от параметров реакции. Это – диффузионный режим, а массоперенос – лимитирующая стадия.
Лимитирующая стадия – этап многостадийного процесса, характеризующийся максимальной движущей силой или минимальной интенсивностью. Лимитирующая стадия определяет режим, или область протекания, процесса.
Влияние температуры сказывается на значении константы равновесия K н. Представим эту зависимость в координатах «ln K н – 1/ T» (рисунок 5.5, а). На графике пунктиром показана зависимость константы скорости от температуры. При небольших температурах (правая часть графика) константа скорости реакции мала (k << β) – режим кинетический. В этой области наблюдаемая константа скорости превращения совпадает с константой скорости реакции. При больших температурах (левая часть графика) k >> β – режим диффузионный; здесь наблюдаемая константа скорости превращения равна коэффициенту массообмена и практически не зависит от температуры. Нагрев на 100С увеличивает скорость реакции примерно вдвое, а скорость диффузии – на несколько процентов. Между этими областями температур лежит переходная область.
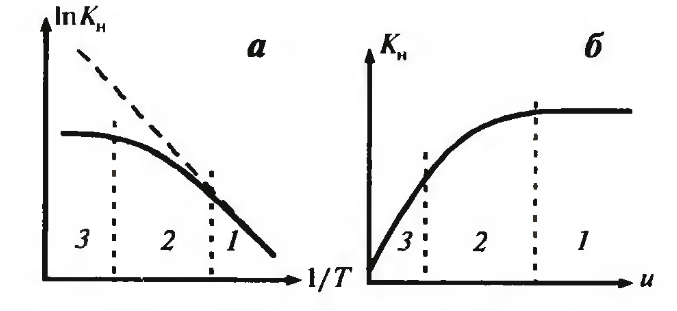
Рис.5.5 Зависимость наблюдаемой константы Kн скорости
превращения в гетерогенном процессе от температуры Т (а) и
скорости обтекания частицы u (б). Режимы процесса:
1 – кинетический; 2 – переходный; 3 – диффузионный
Коэффициент массообмена зависит от влияния скорости потока. При малой скорости потока можно полагать k << β – режим диффузионный. При больших скоростях потока с возрастанием коэффициента массообмена режим процесса переходит в кинетический и перестаёт зависеть от скорости потока (рис.5.5 б).
Интенсификация процесса определяется по уменьшению времени полного превращения t к (5.34):
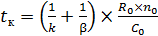 . (5.34)
. (5.34)
Из структуры этого выражения видны пути уменьшения t к и, следовательно, интенсификации процесса:
– увеличение концентрации компонента в газе С 0;
– дробление частиц – уменьшение R 0;
– увеличение константы скорости k подъёмом температуры (особенно в кинетической области);
– увеличение коэффициента массообмена β турбулизацией потока, увеличение скорости обтекания им частицы (особенно в диффузионной области). Влияние температуры и скорости обтекания частицы на интенсификацию процесса ограничено.
Подводя итоги, можно сделать следующие выводы:
– скорость гетерогенной реакции определяется скоростью лимитирующей стадии;
– в качестве лимитирующих могут быть как процессы химического превращения, так и процессы массопередачи;
– для интенсификации гетерогенной реакции следует использовать как кинетические, так и диффузионные факторы;
– для интенсификации процессов, протекающих в кинетической области, следует применять кинетические факторы;
– для интенсификации процессов, протекающих в диффузионной области, следует применять диффузионные факторы.
 2015-08-21
2015-08-21 4118
4118
