Необратимая реакция A = R представлена кинетическим уравнением (5.2):
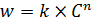 . (5.2)
. (5.2)
Зависимость скорости реакции от концентрации показана на рисунке 5.1 (а).
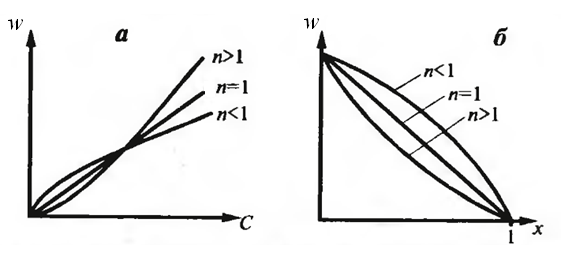
Рис. 5.1 Зависимость скорости простой необратимой реакции w
от концентрации С (а) и степени превращения х (б) исходного
реагента; n – порядок реакции
Перейдя к степени превращения, получим:
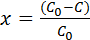 , (5.3)
, (5.3)
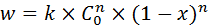 . (5.4)
. (5.4)
Зависимость w = f (x) изображена на рисунке 5.1 (б). Порядок реакции изменяет темп возрастания скорости с концентрацией – он выше для реакции более высокого порядка.
Константа скорости k зависит от температуры по уравнению Аррениуса (5.5):
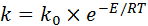 , (5.5)
, (5.5)
где Е – энергия активации.
Характер изменения w = f (T) будет таким же, как и k = f (T) (рисунок 5.2, а). Для двух реакций с различными энергиями активации Е 1 и Е 2 скорость возрастает с температурой больше у той реакции, у которой энергия активации больше (рисунок 5.2, а). Увеличение температуры изменит зависимости w = f (C) и w = f (x).
Концентрационная (рисунок 5.2, б) и конверсионная (рисунок 5.2, в) кривые скорости реакции показаны при температурах Т 1 и Т 2, причём Т 2 > Т 1. При более высокой температуре Т 2 скорость процесса больше: с увеличением температуры возрастает константа скорости k и скорость реакции тоже возрастает. Рост температуры обусловливает интенсификацию процесса для необратимой реакции. Если необходимо достичь максимальной интенсивности, то температура должна быть максимально возможной, допустимой для данной реакционной системы, при любых концентрациях (степени превращения) Ограничение на температуру обусловлено появлением нежелательных реакций, возможностью самовоспламенения, устойчивостью материала аппаратуры.
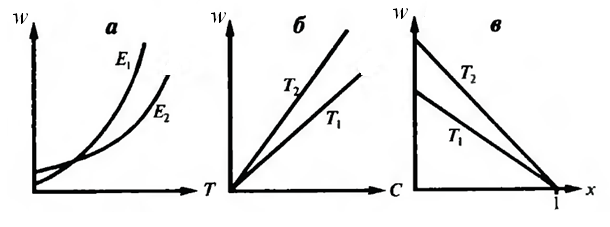
Рис.5.2 Влияние температуры Т на скорость простой необратимой
реакции:w = f(T) (a) для реакций с энергиями активации Е1 и Е2
(Е1> Е2);w = f(C) (б) и w = f(x) (в) при температурах Т1 и Т2 (Т2> Т1)
Обратимая реакция A «R представлена кинетическим уравнением первого порядка (5.6) в обоих направлениях:
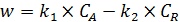 . (5.6)
. (5.6)
Поскольку скорость реакции зависит от концентраций двух компонентов, то зависимость w = f (CA) будет представлена серией кривых, полученных при разных значениях CR (рисунок 5.3, а).
Равновесие обратимой реакции, когда w = 0, будет при определённом соотношении C R/ C A = K p.
Точка 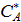 пересечения кривой w = f (CA) с осью абсцисс при каждом значении C R на рисунке 5.3 (а) отвечает равновесию при концентрациях
пересечения кривой w = f (CA) с осью абсцисс при каждом значении C R на рисунке 5.3 (а) отвечает равновесию при концентрациях  и C R. Если
и C R. Если  , то скорость становится отрицательной (пунктир на рисунке 5.3 а) – реакция протекает в обратном направлении.
, то скорость становится отрицательной (пунктир на рисунке 5.3 а) – реакция протекает в обратном направлении.
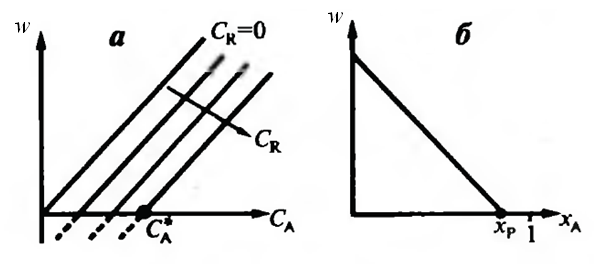
Рис.5.3 Зависимость скорости обратимой реакции w от концентрации
исходного компонента СА при различных значениях концентрации
продукта CR (а) и от степени превращения хА (б)
Чтобы получить однофункциональную зависимость для скорости реакции, перейдём к степени превращения х для компонента А:
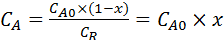 (5.7)
(5.7)
и
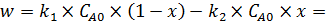
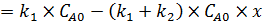 . (5.8)
. (5.8)
Зависимость w = f (x) – линейно убывающая (рисунок 5.3 б). При некотором значении 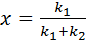 достигнем w = 0.
достигнем w = 0.
От температуры зависят две константы в кинетическом уравнении k 1 и k 2. Обе константы увеличиваются с ростом температуры, но их влияние на скорость противоположно: увеличение k 1 ускоряет реакцию, а k 2 – замедляет. Их совместное влияние зависит от того, какая из констант быстрее увеличивается с температурой, от соотношения энергий активации прямой и обратной реакций. Последнее различно для экзо- и эндотермической реакции.
Зависимость w = f (x) – убывающая линия между w = k 1CA0 при х = 0 и w = 0 при равновесной степени превращения хр. С увеличением температуры начальная скорость увеличивается. Равновесие изменится в зависимости от того, какая протекает реакция – экзо- или эндотермическая. В эндотермической реакции равновесная степень превращения возрастает, и скорость реакции возрастает во всём интервале изменения х от х = 0 до хр (кривая 1 на рисунке 5.4).
Равновесие в экзотермической реакции сдвигается влево. Увеличение температуры приведёт к увеличению скорости при небольших значениях х. Начиная с некоторого значения х, скорость реакции станет меньше, несмотря на более высокую температуру (кривая 2 на рисунке 5.4).
Сложная реакция состоит из этапов или частных реакций. Характер зависимости их скоростей от концентраций и температуры такой же, как для простой реакции. В сложной реакции продукты образуются в разных частных реакциях, и появляется характеристика процесса, связанная с соотношением скоростей образования таких продуктов.
Дифференциальная селективность – отношение скорости превращения исходного вещества в определённый продукт к общей скорости его превращения.
Селективность, определённая как доля исходного вещества, превратившегося в нужный продукт, характеризует конечный результат процесса и называется интегральной селективностью.
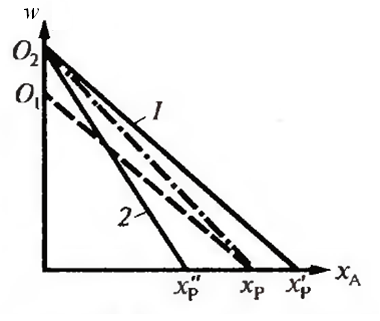
Рис. 5.4 Зависимость скорости обратимой реакции первого порядка
от степени превращения хА при температурах Т1 (пунктир) и Т2 > Т1 (сплошные линии): 1 – эндотермическая реакция; 2 – экзотермическая
реакция; штрихпунктирная линия – при увеличении начальной
концентрации и температуре Т1
| Параллельная схема превращения: |  |
Здесь обозначены константы скоростей (k 1 ,k 2), энергии активации (Е 1, Е 2) и порядки (n 1, n 2) частных реакций. Дифференциальная селективность по R:
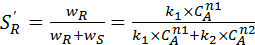 (5.9)
(5.9)
где wR, wS – скорости образования продуктов R и S.
Если порядки частных реакций одинаковы (n 1 = n 2),
то 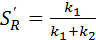 и не зависит от концентрации.
и не зависит от концентрации.
Если n 1 > n 2, то 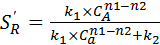 и возрастает с увеличением С А. С увеличением С А скорость реакции A ® R больше, чем A ® S, увеличивается доля первого этапа в общей скорости превращения исходного вещества.
и возрастает с увеличением С А. С увеличением С А скорость реакции A ® R больше, чем A ® S, увеличивается доля первого этапа в общей скорости превращения исходного вещества.
Если n 1 < n 2, то 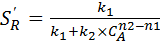 и уменьшается с увеличением С А, поскольку сильнее возрастает скорость образования R.
и уменьшается с увеличением С А, поскольку сильнее возрастает скорость образования R.
Из полученных данных можно сделать следующие выводы о целесообразном режиме проведения процесса с параллельной схемой превращения.
Если порядок реакции образования целевого продукта больше, чем порядки реакций образования других продуктов, процесс выгоднее проводить при высоких концентрациях исходных веществ – и селективность, и интенсивность процесса будут наибольшими.
При равных порядках частных реакций концентрация не влияет на селективность, и повышение концентрации целесообразно для увеличения скорости реакции.
Если порядок реакции образования побочного продукта больше, то селективность будет увеличиваться при снижении концентрации. Однако скорость превращения будет уменьшаться.
Повышение температуры приведёт к увеличению дифференциальной селективности, если при этом скорость образования продукта R возрастёт больше, чем скорость образования продукта S. Это возможно в случае, когда Е 1 > Е 2. При обратном соотношении энергий активации увеличению селективности будет способствовать снижение температуры в ущерб интенсивности.
| Последовательная схема превращения: | 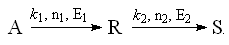 |
Скорость первой и второй стадий:
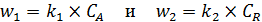 . (5.10)
. (5.10)
Скорость образования целевого продукта R:
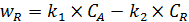 . (5.11)
. (5.11)
Скорость общего превращения исходного вещества A:
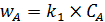 . (5.12)
. (5.12)
Дифференциальная селективность по продукту R:
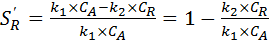 . (5.13)
. (5.13)
зависит от концентрации двух реагентов.
При некотором соотношении CR и CA, а именно CR / CA = k 1/ k 2, скорость образования R из А и дальнейшего превращения R в S будут равны, и дифференциальная селективность будет равна нулю. Если отношение CR / CA превышает это значение, дифференциальная селективность станет отрицательной. Отметим, что интегральная селективность – всегда положительная величина.
Влияние температуры проследим при заданных концентрациях CR и CA. Если Е 1 > Е 2, то с повышением температуры k 1 увеличится сильнее, чем k 2, и как следует из формулы 5.13, дифференциальная селективность будет возрастать. При обратном соотношении энергий активации частных реакций температура будет отрицательно сказываться на селективности.
5.4. Характеристика гомогенных процессов
Гомогенные процессы, то есть процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности. Чисто гомогенную систему получить трудно, так как любое вещество содержит примеси. Для многих промышленных процессов воздух считается гомогенной средой, а для процесса окисления аммиака тот же воздух из-за наличия в нем пыли, влаги считается гетерогенной средой. Исходное сырье всегда имеет примеси. Поэтому лишь условно можно принять за гомогенные те производственные процессы, которые протекают в газовой или жидкой фазе. В гомогенных системах реакции проходят быстрее, чем в гетерогенных. Осуществление и управление гомогенными процессами, протекающими в гомогенной среде, значительно облегчается. Аппаратура тоже упрощается. Поэтому многие промышленные гетерогенные процессы включают в качестве этапа гомогенный химический процесс в газовой или жидкой фазе. Для гомогенизации системы при проведении химической реакции в однородной среде в промышленности используют разные способы:
– поглощение газов, конденсация паров, растворение или плавление твердых материалов приводящей к получению жидкой среды, в которой быстрее протекают реакции.
– испарение жидкостей или выделение из них в газовую фазу нужных компонентов и проведение реакции в газовой фазе. Например, в башенном методе получения серной кислоты после поглощения окислов азота гомогенно идет образование нитрозилсерной кислоты. В этом же способе используется и газовая реакция окисления двуокиси серы в трехокись при каталитическом действии газообразных окислов азота. Так проводятся многие реакции синтеза, разложения. Рассмотрим характеристики некоторых реакций.
Ассоциацией называется соединение некоторого числа одинаковых молекул в более крупные частицы. Ассоциация молекул происходит как в индивидуальных веществах в жидком и газообразном состоянии, так и в растворах. Например, газообразная двуокись азота в определенных условиях дает четырехокись (реакция 5.14), что и используется при прямом синтезе концентрированной азотной кислоты
NО2 + NО2 ↔N2О4. (5.14)
Уменьшение температуры и рост давления и концентрации увеличивают степень ассоциации и, наоборот, при повышении температуры и снижении давления и концентрации полученный компонент диссоциирует, то есть процесс является обратимым.
Полимеризацией называют процесс соединения большого числа молекул мономера в одну большую молекулу того же состава. Следовательно, при полимеризации не происходит выделения каких-либо побочных продуктов. К полимеризации склонны ненасыщенные соединения, имеющие двойные и тройные связи, а также и насыщенные соединения циклического строения. Полимеризация непредельных углеводородов идет с выделением тепла и уменьшением общего числа молекул в системе, то есть с уменьшением объема, например (5.15),
nСН2=СН2 → (-СН2-СН2-)n. (5.15)
Поэтому повышение давления и понижение температуры способствует ходу процесса. При деполимеризации происходит отщепление мономерных единиц от цепи макромолекулы. В промышленности широко используется гомогенная реакция диссоциации электролита на ионы. При высокой температуре диссоциирует и аммиак (5.16)
2NН3 ↔ N2 + 3Н2. (5.16)
Эта реакция в газовой фазе начинается при 900 – 10000С
Крекинг – метод деструктивной переработки, являющийся частным случаем пиролиза для жидкостей и газов.
Пиролиз – это термическая переработка горючих материалов при температуре 400 – 15000С без доступа воздуха. При пиролизе в результате воздействия высоких температур органические вещества расщепляются с образованием свободных радикалов, предельных и непредельных углеводородов меньшего молекулярного веса, чем исходные. Процессы крекинга углеводородов, полимеризации, да и многие другие химические реакции протекают по цепному механизму. Зарождение цепи происходит вследствие инициирующего действия некоторых высокоактивных веществ или света, высокой температуры. Развитие цепи протекает самопроизвольно. Цепные реакции затухают из-за обрыва цепи.
5.5. Основные закономерности гомогенных процессов
Гомогенные процессы, как правило, идут в кинетической области, то есть общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и к процессам, идущим в газовой и жидкой среде.
К одномолекулярным реакциям относятся:
– реакции внутримолекулярных перегруппировок А → Д, например, изомеризация, инверсия;
– реакции разложения А → Д + Д′.
В качестве примера можно указать крекинг этана по реакции (5.17):
С2Н6 → С2Н4 + Н2. (5.17)
В бимолекулярных реакциях элементарный акт осуществляется в результате встречи двух одноименных (2А) или разноименных (А + В) молекул исходных веществ. Бимолекулярные реакции в свою очередь можно подразделить на:
– реакции присоединения А + А → АА, А + В → АВ и разложения 2А → Д + Д′;
– реакции замещения или обмена А + ВВ′ → АВ + В′;
– реакции двойного обмена АА′ + ВВ′ → АВ + А′В′.
К бимолекулярным реакциям присоединения относятся присоединение атома или радикала к молекуле непредельного соединения и ассоциация насыщенных молекул. Например, реакции (5.18, 5.19):
С2Н4 + Н2 → С2Н6; (5.18)
Н2 + І2 → 2НІ. (5.19)
К реакциям замещения или обмена принадлежит большое количество реакций атомов и радикалов с различными молекулами. Типичная реакция двойного обмена в растворе (5.20):
КСl + NаNО3 → ΝаСl + КNО3. (5.20)
В трехмолекулярных реакциях встречаются и вступают в химическое взаимодействие три молекулы; могут быть реакции присоединения, обменного типа и реакции рекомбинации: 3А → Д,
2А + В → Д + Д′, А + А′ + В → Д + Д′.
Так протекает взаимодействие хлорного железа и хлористого олова в водном растворе по реакции (5.21):
2FеСl3 + SnСl2 ↔ 2FеСl2 + SnСl4. (5.21)
Каждому из перечисленных типов реакций соответствует свое кинетическое уравнение, связывающее концентрации реагентов со временем. Порядок реакции совпадает с её молекулярностью только для простых реакций, протекающих в соответствии с уравнением реакции в одном направлении и содержащих один химический этап. Влияние концентраций реагирующих веществ определяется законом действия масс, который является основным законом химической кинетики. С ростом концентрации исходных веществ скорость реакции до достижения равновесного выхода увеличивается тем сильнее, чем выше порядок реакции. С ростом концентрации исходных веществ скорость реакции до достижения равновесного выхода увеличивается тем сильнее, чем выше порядок реакции. Скорость реакции наиболее сильно зависит от концентраций тех реагирующих веществ, которые входят в наибольшем количестве в уравнения химических реакций. При этом скорость многомолекулярных реакций с повышением концентраций будет возрастать быстрее, чем скорость реакций более низших порядков. Для повышения концентраций реагентов в гомогенных системах применяются следующие методы:
– для газов: выделение из газовой смеси в более концентрированном виде, сжатие или сжижение, растворение газов для проведения реакции в растворе;
– для жидкостей: выпаривание, вымораживание, что позволяет получить раствор более насыщенный реагентами или же дополнительный ввод реагента в раствор.
Повышение температуры увеличивает скорость реакции вследствие возрастания константы скорости согласно уравнению Аррениуса. Но повышение температуры обычно увеличивает и скорость обратной реакции (а иногда и параллельных или вызывает реакции образования побочных продуктов), в результате чего равновесие наступает при низком выходе продукта. Поэтому необходимо найти оптимальные условия, при которых константа равновесия достаточно высока при большой скорости прямой реакции. Зависимость скорости химической реакции от температуры сильно изменяется при возрастании порядка реакции.
Давление влияет на увеличение скорости как прямой, так и обратной реакции пропорционально числу реагирующих молекул. Таким образом, давление влияет в основном через увеличение концентраций реагентов, что практически относится к реакциям, идущим в газовой среде, особенно с уменьшением объема. Давление сдвигает равновесие реакции, если она идёт с изменением объёма (по принципу Ле-Шателье), и ускоряет реакции из-за увеличения плотности и, следовательно, концентрации реагирующих веществ. Если равновесие не является лимитирующей стадией, то влияние давления зависит от порядка реакции (5.22):
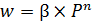 , (5.22)
, (5.22)
где β – коэффициент, зависящий от константы скорости реакции и концентраций реагирующих веществ,
Р – безразмерное давление, то есть отношение фактического давления к нормальному (0,1 МПа),
n – порядок реакции.
Следовательно,
– для реакций первого порядка 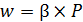 ;
;
– для реакций второго порядка 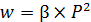 .
.
Таким образом, чем выше порядок реакции и чем чище исходная газовая смесь, тем целесообразнее применять давление. Применение давления выгодно и потому, что оно позволяет уменьшить диаметр трубопроводов, размеры аппаратов, но при этом увеличивается толщина их стенок. Давление на скорость реакций в растворах влияет очень мало, но с увеличением давления быстро возрастает вязкость жидкостей, что может привести к переходу реакции из кинетической области в диффузионную. По тому, как сказывается давление на жидкофазные гомогенные реакции, их можно разделить на три группы:
– мономолекулярные реакции разложения, замедляемые давлением;
– нормальные бимолекулярные реакции, ускоряемые давлением;
– медленные бимолекулярные реакции, значительно ускоряемые давлением.
Перемешивание ускоряет процессы, протекающие в диффузионной области вследствие замены медленной молекулярной диффузии быстрым конвективным переносом реагентов в зону реакции. Особенно эффективно перемешивание жидких гомогенных систем, в которых молекулярная диффузия происходит медленнее, чем в газовых. Перемешивание влияет на скорость процессов, идущих в кинетической области в зависимости от типа процесса. Для большинства газовых реакций перемешивание не влияет на скорость, так как каждая молекула газа в обычных условиях и без перемешивания испытывает около 1010 столкновений в секунду. В проточных же реакторах скорость реакции при прочих равных условиях снижается с увеличением степени перемешивания вследствие снижения средней движущей силы процесса.
Для гомогенных реакций, проводимых в газовой среде, можно использовать реакционные аппараты простого устройства, в частности, полый объем без перемешивания или с перемешиванием.
Для процессов в жидкой фазе также используются реакционные емкости без перемешивания (баки, цистерны, котлы) и смесители с механическим (лопастные, пропеллерные и другие виды мешалок), пневматическим, струевым, центробежным и прочими видами перемешивания. Перемешивание обеспечивает не только получение однородных физических смесей, но и интенсификацию многих реакций и идущих при этом процессов тепло и массообмена. При работе под давлением применяют автоклавы.
Гомогенные процессы в газовой фазе широко применяются в технологии органических веществ. Для осуществления этих процессов органическое вещество испаряется, и затем его пары обрабатываются тем или иным газообразным компонентом: хлором, окислами азота, сернистым ангидридом и т.п. Значительное применение получил парофазный пиролиз, в котором химические реакции разложения осуществляются в паровой фазе, хотя процесс в целом относится к гетерогенным, поскольку химическим реакциям в паровой фазе предшествует испарение углеводородов.
Хлорирование углеводородов или их производных осуществляется при получении органических растворителей, ядохимикатов и разнообразных продуктов органического синтеза. В зависимости от применяемых средств инициирования различают следующие методы хлорирования: термическое, фотохимическое и каталитическое. Первые два метода – гомогенные. При термическом хлорировании энергия активации равна 20 ккал/моль. Процесс осуществляется при температуре 250 – 4000С. Чем менее реакционноспособны углеводороды, тем выше температура. При хлорировании метана последовательным замещением его водородных атомов получается смесь четырех производных (5.23 – 5.26):
СН4 + Сl2 → СН3Сl + НСl, (5.23)
СН3Сl + Сl2 → СН2Сl2 + НСl, (5.24)
СН2Сl2 + Сl2 → СНСl3 + НСl, (5.25)
СНСl3 + Сl2 → ССl4 + НСl. (5.26)
Изменяя условия процесса, соотношение исходных продуктов, режим хлорирования, можно направить реакцию в сторону преимущественного образования того или иного хлорпроизводного. Фотохимическое хлорирование углеводородов осуществляется по цепному механизму с большой скоростью при невысоких температурах в жидкой или паровой фазе, и направление этой реакции часто бывает иное, чем при термическом хлорировании. Энергия активации фотохимического хлорирования равна 10 – 15 ккал/ моль.
Сульфохлорирование, то есть одновременное действие сернистого ангидрида и хлора на предельные углеводороды, используется для производства моющих средств. Это типичная цепная реакция, которую действием ультрафиолетового света удается селективно направить в сторону образования сульфохлорида.
Интерес представляет получение хлористого винила высокотемпературным хлорированием этилена. В этом случае с повышением температуры выше 3000С реакция замещения водорода на хлор начинает преобладать над реакцией присоединения хлора по двойной связи, при этом получается хлористый винил с высоким выходом.
Гомогенно в жидкой или паровой фазе осуществляются и процессы нитрования. При парофазном нитровании исходные реагенты можно смешивать в любых соотношениях и процесс ведется при высоких температурах. При этом возрастает скорость реакции, более полно используется азотная кислота или окислы азота и резко снижается выход полинитросоединений.
Гомогенные процессы в жидкой фазе характеризуются большей интенсивностью, чем в газовой. Из большого числа процессов, идущих в жидкой фазе, можно отнести к гомогенным процессы нейтрализации щелочи в технологии минеральных солей без образования твердой соли. Например, получение сульфата аммония при взаимодействии аммиачной воды и серной кислоты. По такому принципу протекают и некоторые обменные реакции, идущие в растворах.
В жидкой фазе получают простые и смешанные эфиры из спиртов, так, например, этилсульфат разлагают спиртом по реакции (5.27):
С2Н5ОSО2ОН + СН3ОН ↔ С2Н5ОСН3 + Н2SО4. (5.27)
При этом происходит образование некоторых сложных эфиров, процессы гидролиза этилсерной кислоты.
В гомогенной среде идут и такие важные процессы, как получение адипиновой кислоты:
3С6Н11ОН + 8НNО3 ↔ 3С6Н10О4 + 7Н2О + 8ΝО, (5.28)
синтез метилового спирта в присутствии серной кислоты. Жидкофазная полимеризация в растворах применяется в производстве лаков и некоторых смол.
 2015-08-21
2015-08-21 2500
2500
