Многочисленные исследования показали, что каталитическая реакция протекает на поверхности катализатора, поэтому для объяснения механизма катализа необходимо рассмотреть процесс адсорбции. Известно, что адсорбция – это процесс самопроизвольного изменения концентрации вещества на границе раздела фаз, сопровождающийся уменьшением свободной энергии Гиббса.
В гетерогенном катализе адсорбентом служит твердый катализатор, а адсорбатом – молекула реагирующего вещества. При этом различают физическую и химическую адсорбцию (хемосорбцию), хотя четкой грани между ними нет.
Физическая адсорбция всегда экзотермична. Это объясняется тем, что при физической адсорбции возрастает упорядоченность молекул реагента в адсорбционном слое по сравнению с газовой или жидкой фазами, и поэтому энтропия всегда уменьшается. Физическая адсорбция имеет невысокую специфичность, так как её величина слабо зависит от химического состава поверхности катализатора. Скорость физической адсорбции незначительно зависит от температуры, но количество адсорбированного вещества с ростом температуры при постоянном давлении быстро уменьшается.
Хемосорбция – это поверхностная химическая реакция, которую можно рассматривать как химическое взаимодействие газа или растворенного вещества с поверхностью твердого катализатора, не сопровождающееся образованием объемной фазы.
Величины энтальпии хемосорбции, как и в любой химической реакции, лежат в широком интервале значений. Как правило, процесс хемосорбции является экзотермическим. Но при хемосорбции энтропия адсорбции не всегда меньше нуля, поэтому принципиально возможна хемосорбция и с поглощением тепла. В отличие от физической адсорбции, хемосорбция высокоспецифична по отношению к химической природе адсорбента и поэтому очень чувствительна к чистоте поверхности катализатора.
Температурная область протекания хемосорбции не имеет ограничений. Она может протекать как при низких, так и при высоких температурах. С ростом температуры количество хемосорбированного вещества уменьшается, а скорость процесса возрастает в соответствии с уравнением Аррениуса.
Из двух видов адсорбции только хемосорбция приводит к заметному изменению энергетического состояния адсорбированной молекулы и существенному увеличению ее реакционной способности за счет снижения энергии активации, что и объясняет каталитический эффект. Но физическая адсорбция может предшествовать хемосорбции и являться стадией каталитического процесса.
6.2.1. Теория адсорбции Лэнгмюра
Позволяет дать количественную оценку значимости процесса адсорбции, основанную на предложенной им модели. И. Лэнгмюр сделал следующие допущения:
– поверхность адсорбента состоит из определенного числа одинаковых адсорбционных центров;
– вероятность адсорбции на всех центрах одинакова;
– каждый адсорбционный центр может удерживать только одну частицу (молекулу или атом), поэтому процесс адсорбции заканчивается образованием на поверхности раздела фаз слоя толщиной в одну молекулу (мономолекулярный адсорбционный слой);
– силами притяжения и отталкивания между молекулами или атомами, адсорбированными на соседних центрах, можно пренебречь.
Из этих допущений следуют выводы:
– скорость адсорбции пропорциональна числу столкновений молекул адсорбата со свободными адсорбционными центрами на поверхности адсорбента;
– скорость десорбции пропорциональна числу занятых мест на поверхности адсорбента;
– скорость реакции между адсорбированными молекулами пропорциональна произведению величин адсорбции каждого из веществ.
Рассмотрим несколько механизмов адсорбции.
Механизм 1. Процесс хемосорбции вещества А из газовой фазы схематически можно представить следующим образом (6.1):
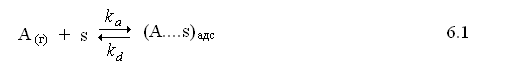
где s – свободный адсорбционный центр поверхности адсорбента,
(А…..s)адс– адсорбированная частица или «заполненный» центр адсорбции,
ka – константа скорости адсорбции частицы А,
kd – константа скорости десорбции.
Для вывода кинетического уравнения процесса хемосорбции введем понятие степени заполнения поверхности или доли занятых адсорбированными молекулами центров:
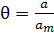 , (6.2)
, (6.2)
где а – величина адсорбции при заданном давлении,
аm – предельная величина адсорбции, равная емкости монослоя.
По закону действующих поверхностей скорость адсорбции wa пропорциональна доле свободной поверхности и давлению газа (6.3):
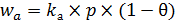 , (6.3)
, (6.3)
где (1 – q) – доля свободной поверхности.
Скорость десорбции пропорциональна степени заполнения (6.4):
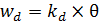 . (6.4)
. (6.4)
Общая скорость процесса адсорбции
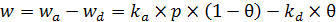 . (6.5)
. (6.5)
После установления равновесия между газовой и адсорбционной фазами, общая скорость процесса адсорбции равна нулю. Следовательно, имеет место выражение (6.6):
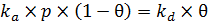 . (6.6)
. (6.6)
Решая соотношение (6.6) относительно q и вводя константу адсорбционного равновесия (6.7)
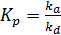 , (6.7)
, (6.7)
получаем уравнение изотермы Лэнгмюра (6.8):
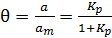 . (6.8)
. (6.8)
Часто вместо Kp применяют введенную автором теории величину b, которую называют адсорбционным коэффициентом вещества А. Для обратимой адсорбции b имеет физический смысл константы равновесия между веществом на поверхности и в газовой фазе (6.9)
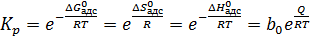 , (6.9)
, (6.9)
где b 0 – коэффициент, связанный с величиной энтропии адсорбции,
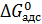 – энергия Гиббса адсорбции,
– энергия Гиббса адсорбции,
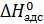 – энтальпия адсорбции,
– энтальпия адсорбции,
Q – теплота адсорбции.
Для реакции (6.1) условие адсорбционного равновесия выразим через химические потенциалы исходных и конечных продуктов (6.10):
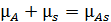 . (6.10)
. (6.10)
Для газовой фазы можно записать (6.11):
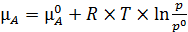 , (6.11)
, (6.11)
где р – давление компонента А в газовой фазе;
p 0 – стандартное давление (если его измеряют в атмосферах или бар, то p 0 = 1).
Для свободных адсорбционных центров запишем (6.12):
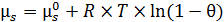 . (6.12)
. (6.12)
Для занятых адсорбционных центров запишем (6.13):
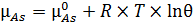 . (6.13)
. (6.13)
Из условия адсорбционного равновесия можно записать (6.14):
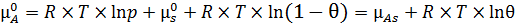 . (6.14)
. (6.14)
Перегруппировав слагаемые в уравнении (6.14), получим выражение (6.15):
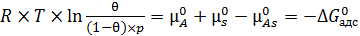 , (6.15)
, (6.15)
где 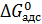 – изменение энергии Гиббса адсорбции.
– изменение энергии Гиббса адсорбции.
Величина 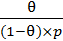 имеет физический смысл константы адсорбционного равновесия. Поэтому запишем выражение (6.16):
имеет физический смысл константы адсорбционного равновесия. Поэтому запишем выражение (6.16):
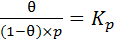 . (6.16)
. (6.16)
Решая уравнение (6.16) относительно q, приходим к уравнению Лэнгмюра (6.17):
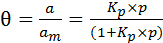 . (6.17)
. (6.17)
Если равновесное давление остается достаточно малым, то есть выполняется условие Кр 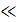 1, то можно записать (6.18):
1, то можно записать (6.18):
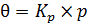 . (6.18)
. (6.18)
Следовательно, в этом случае q растет пропорционально давлению (рисунок 6.2).
Если равновесное давление достаточно велико, чтобы выполнялось условие 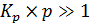 , то получаем q = 1.
, то получаем q = 1.
Это значит, что величина q не зависит от давления, и поверхность полностью покрыта мономолекулярным слоем реагента. При этом наступает состояние насыщения.
Как следует из рисунка 6.2, при значении 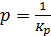 ,
, 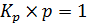 , и степень заполнения q = ½. При этом касательная достигает значения
, и степень заполнения q = ½. При этом касательная достигает значения
q = 1 именно в точке 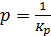 .
.
Для нахождения параметров уравнения Лэнгмюра – величин предельной адсорбции ат и константы адсорбционного равновесия Kp – обработку зависимости адсорбции а от давления р можно проводить тремя способами. Рассмотрим один из них.
Записав уравнение (6.17) в обратных величинах, получим выражение (6.19):
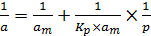 . (6.19)
. (6.19)
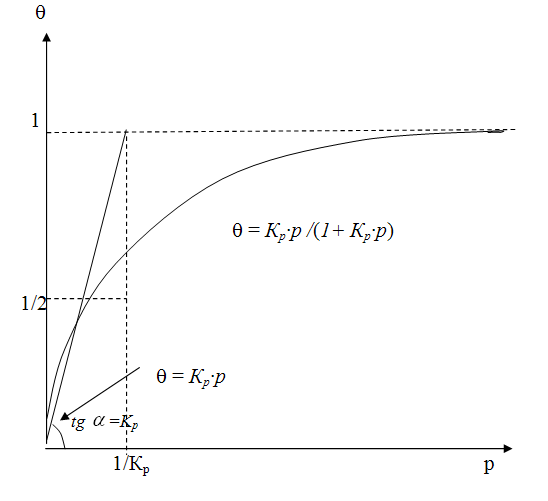
Рис. 6.2. Изотерма адсорбции Лэнгмюра
Из графика, построенного в координатах 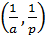 , находим ат по отрезку, отсекаемому прямой на оси ординат, и K – по тангенсу наклона прямой и указанному значению ат:
, находим ат по отрезку, отсекаемому прямой на оси ординат, и K – по тангенсу наклона прямой и указанному значению ат:
Механизм 2. Адсорбция молекулы А2 сопровождается ее диссоциацией на атомы. Схематически это можно изобразить следующим образом (6.20):
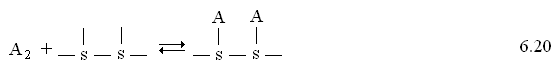
Далее запишем уравнение (6.21) скорости адсорбции:
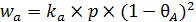 . (6.21)
. (6.21)
Соответственно уравнение скорости десорбции имеет вид (6.22):
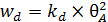 . (6.22)
. (6.22)
В условиях равновесия можем записать выражение (6.23)
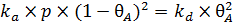 . (6.23)
. (6.23)
Решая уравнение (6.23) относительно q A и принимая, что 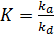 , получим выражение (6.24):
, получим выражение (6.24):
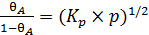 (6.24)
(6.24)
или
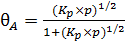 . (6.25)
. (6.25)
В начальный момент адсорбции, когда 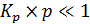 , то
, то 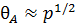 . В дальнейшем для нахождения параметров уравнения (6.25) удобно применить линейную зависимость в виде (6.26):
. В дальнейшем для нахождения параметров уравнения (6.25) удобно применить линейную зависимость в виде (6.26):
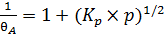 . (6.26)
. (6.26)
Механизм 3. Рассмотрим случай, когда при одновременной адсорбции двух газов происходит их конкуренция за адсорбционные центры. Пусть q A и q B – степени заполнения поверхности соответственно молекулами А и В (без их диссоциации); pA и pB – парциальные давления этих газов. Тогда выражения адсорбции и десорбции примут вид (6.27 – 6.30):
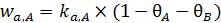 , (6.27)
, (6.27)
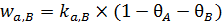 , (6.28)
, (6.28)
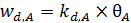 , (6.29)
, (6.29)
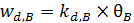 . (6.30)
. (6.30)
При равновесии wa = wb, обозначив
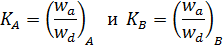
и решая систему уравнений относительно q A и q B, получим
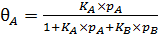 , (6.31)
, (6.31)
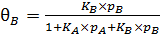 . (6.32)
. (6.32)
Если 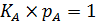 и
и 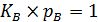 , то
, то 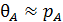 и
и 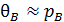 .
.
Если один из газов обладает высокой сорбируемостью, например 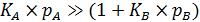 , тогда q A = 1, а
, тогда q A = 1, а 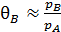 , то есть адсорбция вещества В замедляется адсорбцией вещества А.
, то есть адсорбция вещества В замедляется адсорбцией вещества А.
6.2.2. Нелэнгмюровская адсорбция
Во многих случаях реальная адсорбция не описывается уравнением Лэнгмюра. Причинами, объясняющими отклонения от модели Лэнгмюра, могут быть энергетическая неоднородность поверхностей катализаторов, что приводит к зависимости теплот адсорбции от степени заполнения поверхности адсорбента: уменьшению теплоты адсорбции по мере увеличения степени заполнения; наличие сил притяжения-отталкивания между адсорбированными молекулами.
Ряд авторов предложили уравнения, описывающие частные случаи адсорбции. Среди них следует выделить следующие уравнения.
1. Изотерма Генри (6.33):
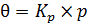 , (6.33)
, (6.33)
которая в ряде случаев представляет собой начальный участок изотермы Лэнгмюра и может выполняться в небольшом интервале степеней заполнения.
2. Изотерма Фрейндлиха (6.34):
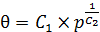 , (6.34)
, (6.34)
где С 1и С 2 – постоянные, причем С 2 > 1.
Изотерму Фрейндлиха часто применяют для описания хемосорбции газов на металлах в области средних заполнений, когда выполняется неравенство 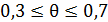 .
.
3. Логарифмическая изотерма (изотерма Темкина) (6.35, 6.36):
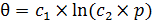 (6.35)
(6.35)
или
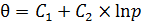 , (6.36)
, (6.36)
где с 1; с 2; С 1и С 2– постоянные.
Следует отметить, что эмпирические выражения (6.35) и (6.36) можно получить как в предположении неоднородности поверхности катализатора, так и при учете сил межмолекулярного взаимодействия.
При физической адсорбции, когда энергии межмолекулярных связей соизмеримы, после насыщения первого адсорбционного слоя может наступать полимолекулярная адсорбция с образованием второго и последующих адсорбционных слоев. Полимолекулярная адсорбция наблюдается во многих процессах с участием органических веществ при повышенных давлениях.
Модель для описания полимолекулярной адсорбции предложили С. Брунауэр, П. Эммет и Э. Теллер. Ее основные допущения таковы:
– учитывается только минимальная совокупность парных взаимодействий молекул, которая может привести к возникновению полимолекулярного слоя;
– при значительной разнице в теплотах адсорбции первого и последующих слоев принимается (6.37):
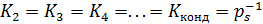 , (6.37)
, (6.37)
где K 2, K 3, K 4и т.д. – константы равновесного взаимодействия пары частиц во втором и далее слоях,
K конд – константа равновесия процесса конденсации,
рs – давление насыщенного пара адсорбата при температуре опыта.
Уравнение полимолекулярной адсорбции, названное БЭТ (аббревиатура от фамилий авторов модели), имеет следующий вид (6.38):
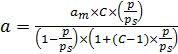 . (6.38)
. (6.38)
Для определения параметров ат и С уравнение БЭТ приводят к линейному виду (6.39):
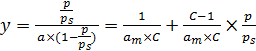 . (6.39)
. (6.39)
Строя графическую зависимость в координатах 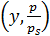 , находят величину отрезка, отсекаемого на оси ординат (6.40):
, находят величину отрезка, отсекаемого на оси ординат (6.40):
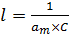 (6.40)
(6.40)
и тангенс угла наклона прямой (6.41):
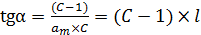 . (6.41)
. (6.41)
С помощью этих данных легко находят искомые параметры (6.42, 6.43):
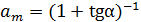 , (6.42)
, (6.42)
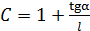 . (6.43)
. (6.43)
Зная ат, можно рассчитать доступную поверхность адсорбента S, если известна эффективная площадка s, занимаемая молекулой адсорбата в плотном слое (6.44):
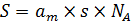 . (6.44)
. (6.44)
Считается, что уравнение БЭТ применимо для определения поверхности с точностью 5 – 10 %, если С > 40. В этих условиях описание полимолекулярной адсорбции до значений 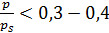 с помощью уравнения БЭТ является достаточно точным.
с помощью уравнения БЭТ является достаточно точным.
Использование уравнения БЭТ оказало большое влияние на теорию и практику катализа, позволило установить количественную связь между скоростью каталитических процессов и величиной поверхности катализаторов.
На макропористых адсорбентах, например цеолитных и алюмосиликатных катализаторах, молекулы адсорбата проникают вглубь кристаллической решетки, характеризующейся наличием полостей. Поэтому понятие поверхностной адсорбции здесь неприменимо. В данном примере оценку величины адсорбции проводят с помощью уравнения из теории объемного заполнения М.М. Дубинина (6.45):
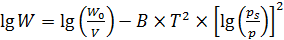 , (6.45)
, (6.45)
где W – адсорбированный объем (в жидком состоянии),
Wo – объем пор,
В – константа,
р – равновесное давление адсорбата при температуре Т,
ps – давление насыщенных паров адсорбата при температуре Т.
Применение уравнения (6.45) ограничено низкими значениями 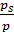 . Для описания адсорбции на цеолитах часто используют эмпирическую формулу (6.46):
. Для описания адсорбции на цеолитах часто используют эмпирическую формулу (6.46):
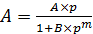 . (6.46)
. (6.46)
где А, В, т – константы для данного вида адсорбата, причем 0 < m < 1.
 2015-08-21
2015-08-21 2812
2812
