Растворение твердых веществ в жидкости можно ориентировочно разграничить на физическое и химическое. Физическое растворение, при котором происходит лишь разрушение кристаллической решетки, обратимо, то есть возможна обратная кристаллизация растворенного вещества. Этот тип растворения встречается в технологии минеральных удобрений и солей. На различной растворимости солей часто основано их разделение, этот прием применяется в производстве хлористого калия из сильвинита и карналлита, медного купороса. Химическое необратимое растворение сопровождается такого рода взаимодействиями растворенного вещества с растворителями или с химически активными веществами, присутствующими в растворе, при котором меняется природа растворенного вещества, и его кристаллизация в первоначальном виде невозможна. Характерным примером химического растворения является растворение металлов в кислотах при травлении поверхности металлов, при получении медного купороса из медных отходов. Наибольшее применение в технике имеет избирательное растворение твердых веществ – экстрагирование или выщелачивание.
Растворение твёрдых тел в жидкостях всегда сопровождается тепловым эффектом: чаще всего поглощением тепла, реже – его выделением. Количество тепла, поглощаемого или выделяемого при растворении единицы массы вещества, называется теплотой растворения. Её величина и знак зависят от природы растворителя и растворяемой соли, температуры, при которой производится растворение, а также от начальной и конечной концентрации раствора, то есть от того, производится ли растворение в чистом растворителе или же в растворе определённой концентрации.
При некоторой концентрации, называемой концентрацией насыщения С н, между твёрдым телом и жидкостью устанавливается равновесие. При нём химический потенциал вещества в растворе становится равным химическому потенциалу того же вещества в твёрдом состоянии. Концентрация насыщения не зависит от давления, однако в значительной степени определяется температурой, с увеличением которой растворимость возрастает, что оказывает сильное влияние на кинетику растворения. С увеличением растворимости возрастает разность концентраций – движущая сила процесса – и растворение ускоряется.
Физическое растворение может протекать по диффузионному, кинетическому и смешанному механизмам. Наиболее распространённым является диффузионный механизм. При растворении на поверхности растворяющегося тела возникает диффузионный пограничный слой, в пределах которого концентрация изменяется от С н на поверхности тела до концентрации С в основной массе раствора. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей её и тела в слое и вне его (естественная конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость которого снижается по мере приближения к поверхности тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамических параметров и уменьшается с увеличением числа Рейнольдса (9.1):
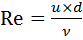 , (9.1)
, (9.1)
где u – скорость обтекания жидкостью растворяющейся частицы,
d – диаметр растворяющейся частицы,
n – кинематическая вязкость жидкости.
Основной закон кинетики диффузионного растворения выражается уравнением (9.2):
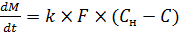 , (9.2)
, (9.2)
где М – масса растворяющегося вещества,
t – время растворения,
k – коэффициент массопередачи,
F – площадь поверхности растворения,
С н – концентрация насыщения,
С – концентрация вещества в растворе.
Основу современной теории растворов создал Д.И. Менделеев. Он установил, что при растворении протекают одновременно два процесса: физический – равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический – взаимодействие растворителя с растворяемым веществом. Последний процесс называют сольватацией, а образующиеся соединения – сольватами. Применительно к водным растворам говорят о гидратации и гидратах.
Процесс сольватации зависит от природы растворенного вещества. При растворении веществ с ионной структурой образование сольватов происходит за счет ион-дипольных взаимодействий или донорно-акцепторных (молекулы растворенного вещества акцепторы, а молекулы растворителя – доноры электронов). Последнее характерно для таких растворителей как вода, аммиак, образуемые сольваты – частный случай комплексных соединений. При растворении веществ с молекулярной структурой сольваты образуются в результате диполь-дипольного взаимодействий.
Так, при растворении хлорида натрия между ионами Na+ и Cl– и полярными молекулами воды возникает ионно-дипольная связь. Она оказывается прочнее, чем межионные связи в молекулах поваренной соли. В результате этого процесса связь между ионами, расположенными на поверхности кристаллов NaCl, ослабляется, ионы натрия и хлора отрываются от кристалла, а молекулы воды образуют вокруг них так называемые гидратные оболочки. Отделившиеся гидратированные ионы под влиянием теплового движения равномерно распределяются между молекулами растворителя.
Взаимодействие между растворенным веществом и растворителем меняется в зависимости от количественных соотношений между ними. При повышении количества растворенного вещества усиливается интенсивность взаимодействий и усложняется структура раствора. При уменьшении доли растворенного вещества взаимодействие ослабевает, и структура раствора упрощается.
Общими приемами интенсификации процессов растворения, выщелачивания, экстрагирования являются увеличение поверхности соприкосновения фаз измельчением твердого вещества, увеличением его пористости и полным омыванием поверхности кристаллов жидкостью, увеличение относительной скорости перемешивания твердой и жидкой фаз (перемешивание). Повышение температуры также может служить одним из наиболее эффективных приемов ускорения процессов растворения и выщелачивания, как в кинетической, так и в диффузионной области. Для процессов растворения, идущих в диффузионной области, преимущественным приемом интенсификации может быть интенсивное перемешивание, которое ускоряет диффузию, выравнивает концентрацию.
Поскольку в большинстве случаев процессы растворения и выщелачивания идут в диффузионной области, для их осуществления применяют реакционную аппаратуру, позволяющую увеличить относительную скорость перемещения растворяемого вещества и растворителя. Для этого пропускают жидкость через фильтрующий или взвешенный слой твердого материала, применяют различные способы перемешивания. Аппараты обогреваются или при помощи рубашек или при помощи внутренних змеевиков.
 2015-08-21
2015-08-21 3252
3252
