Обжигом называется процесс термической обработки материалов, заключающийся в нагреве их до заданной температуры, выдержке при этой температуре и охлаждении. В соответствии с протекающими при обжиге химическими превращениями различают:
– кальцинационный обжиг, цель которого удаление и вещества летучих компонентов, чаще всего оксида углерода и конституционной воды. Например, обжиг известняка по реакции (9.5):
СаСО3= СаО + СО2; (9.5)
– окислительный обжиг, цель которого повышение степени окисления элемента, например (9.6):
6FеО + О2= 2Fе3О4; (9.6)
– восстановительный обжиг, цель которого понижение степени окисления элемента, например (9.7):
Са3(РО4)2+ 5С + 3SiО2= Р2+ 5СО + 3СаSiО3. (9.7)
Обжиг относится к гетерогенным процессам, так как протекает между веществами, находящимися в разных фазах.
Одним из видов гетерогенных процессов являются топохимические реакции – твердофазные реакции, протекающие локально в определенных участках твердого тела.
Понятия «топохимия» и «топохимические реакции» предложены Колшюттером. К топохимическим он относит, по крайней мере, реакции трех типов:
– химические и псевдоморфные превращения минералов (выветривание, дегидратация);
– локализованные реакции в животных и растительных организмах.
В настоящее время вторая группа составляет один из разделов химии твердого тела. Третья группа развилась в самостоятельное направление и заслуживает отдельного рассмотрения в рамках органической, биоорганической или бионеорганической топохимии. В биологии и медицине топохимия развивается как один из разделов гистохимии.
Существуют представления, в соответствии с которыми топохимическими (или топотактическими) называют твердофазные процессы, при которых исходная конфигурация частиц в решетке твердого тела однозначно определяет конфигурацию продукта. Подобные реакции имеют место в органической химии.
Таким образом, в широком смысле термины «топохимия» и «топохимические реакции» используются для обозначения различных явлений: локализации химических и других процессов, химических соединений, химических связей, молекул, атомов.
В узком смысле к топохимическим относят реакции типа (9.8)
Aтв ↔ Bтв + Cгаз, (9.8)
у которых химическое взаимодействие не осложнено диффузионными процессами и локализовано на границе раздела «твердое исходное вещество – твердый продукт реакции». Такое сужение понятия приводит к тому, что из класса топохимических реакций выпадает большая группа твердофазных процессов, для которых характерен эффект локализации, но которые протекают без образования границы раздела твердых фаз. К ним, в частности, относятся реакции термического разложения твердых веществ, протекающие без образования твердого продукта реакции.
Существуют представления, в соответствии с которыми к топохимическим относятся гетерогенные химические процессы, локализованные в определенных местах твердого тела, которое расходуется или образуется в ходе реакции. В некоторых случаях подобное разграничение условно и требует внимательного подхода к интерпретации пограничных явлений между топохимией, с одной стороны, и катализом, кристаллохимией, электрохимией, коллоидной химией и физикой твердого тела – с другой.
На основании вышеизложенного к топохимическим не причисляются реакции, в которых твердое вещество не расходуется и не накапливается, а играет только роль неизменного субстрата (подложки), носителя, катализатора. Такие процессы локализованы на стационарных поверхностях раздела, тогда как топохимические реакции локализованы на постоянно возобновляющихся поверхностях. В топохимических реакциях твердая фаза выступает в роли либо исходного вещества, которое подвергается превращению с образованием новых химических соединений, либо продукта реакции, который образуется в результате химического превращения исходного твердого, жидкого или газообразного вещества. Многие случаи роста кристаллов из растворов, расплавов или газовой фазы, связанные с одновременным протеканием химических процессов (химическая кристаллизация), могут быть отнесены к топохимическим реакциям.
В большинстве случаев топохимические реакции начинаются в области протяженных дефектов кристаллической решетки. В результате образуются зародыши новой фазы продукта и формируются межфазные границы между исходной твердой матрицей и твердой фазой продукта. Дальнейший рост фазы продукта происходит вследствие реакции на этих границах, а скорость процесса пропорциональна поверхности раздела фаз.
Типичные топохимические реакции: обжиг, выщелачивание, химическое травление. Топохимический характер имеют реакции окисления металлов и разложения многих твердых неорганических и органических веществ.
На топохимических реакциях основано восстановление металлов из руд, промышленное получение строительных и полупроводниковых материалов.
Вероятно, к классу топохимических реакций могут быть отнесены некоторые процессы самораспространяющегося высокотемпературного синтеза.
Характерной особенностью топохимических реакций является S-образный вид зависимости степени превращения a от времени (рисунок 9.3).
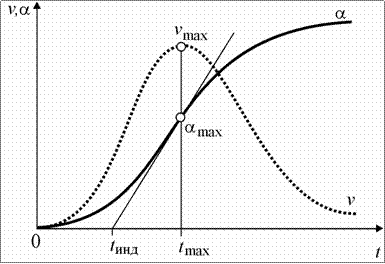
Рис. 9.3. Типичные кинетические кривые топохимических реакций:
a - степень превращения; v - скорость реакции; t - время от начала
реакции; t инд - время индукции; v max, a max, t max - максимальная скорость, соответствующие ей степень превращения и время от начала реакции
В случае, когда реакция протекает чисто в кинетической области, топохимическую реакцию можно представить как последовательность следующих стадий:
– образование отдельных молекул или элементарных ячеек продукта реакции на поверхности исходного вещества;
– возникновение отдельных зародышей (ядер) фазы продукта реакции;
– рост ядер вплоть до смыкания их, образование на поверхности исходного вещества сплошного продукта реакции;
– рост сплошного слоя продукта реакции за счет сокращения объема и поверхности еще не прореагировавшего вещества.
Чтобы получить уравнение кинетики топохимической реакции, нужно знать или предположить, по крайней мере, следующие основные параметры:
– закон образования ядер новой фазы;
– закон роста ядер;
– форму ядер.
Возможны различные сочетания законов образования, роста и формы ядер продукта, поэтому существует большое количество уравнений, описывающих кинетику топохимических реакций. Но наиболее широко применяются лишь несколько из них.
Задачей эмпирической кинетики является нахождение функции f (a), содержащей наименьшее возможное число констант, которые можно было бы интерпретировать и соотносить с другими физическими параметрами системы и процесса. Кроме того, функция f (a) должна наилучшим образом аппроксимировать экспериментальные результаты.
Эмпирический подход в кинетических исследованиях преобладает, поскольку в большинстве случаев практически невозможно подобрать такую физико-математическую модель, которая соответствовала бы характеру топохимического процесса на всем протяжении реакции или температурного интервала:
– при протекании параллельных процессов в полидисперсных системах предпочтительнее использовать физико-математическое описание суммарного процесса;
– в технологии детальное исследование механизма реакции является менее важной задачей, чем оптимизация процесса или определение влияния различных факторов на его скорость;
– использование эмпирических зависимостей позволяет достаточно легко и быстро получать численные характеристики.
В ряде случаев описание кинетики топохимических реакций на основе простых приближенных моделей приводит к достаточно надежным результатам.
Наиболее часто уравнение кинетики топохимических реакций выражается в виде формального соотношения (9.9):
f (a) = a m (1 – a) n, (9.9)
где показатели степени m и n – некоторые постоянные, определяемые механизмом реакции и имеющие смысл кинетических параметров процесса.
Довольно часто считают m = 0, а показателю n приписывают смысл порядка реакции.
Контрольные вопросы
1. Объясните процесс физического растворения. Чем физическое растворение отличается от химического?
2. Что такое теплота растворения? От каких факторов она зависит?
3. Объясните сущность диффузионного механизма растворения.
4. Что такое сольватация и какова её природа?
5. Какие приёмы используют для интенсификации процессов растворения?
6. В чем сущность политермической кристаллизации?
7. Объясните процесс изотермической кристаллизации.
8. Рассмотрите процесс кристаллизации высаливанием.
9. Сущность процесса кристаллизации в результате протекания химических реакций.
10. Назовите наиболее распространённые теории кристаллизации. В чём они заключаются?
11. Какие факторы влияют на размеры кристаллов?
12. Рассмотрите процесс химического осаждения. Где он применяется?
13. Что такое обжиг? Назовите виды обжига, приведите примеры.
14. Какие реакции называют топохимическим? Где они применяются?
15. Рассмотрите механизм топохимических реакций, протекающих в кинетической области.
16. В чём заключается эмпирический подход к изучению топохимических реакций?
 2015-08-21
2015-08-21 1181
1181








