1. Приготовить 0,1н раствор HCl из фиксанала - производить по стандартной методике.
(для удобства пользования разлить равными объемами в три большие конические колбы)
СН(HCl) = 0,1н Заполнить этим раствором рабочую бюретку.
2. Взять навеску соли NH4Cl на аналитических весах (» 0,4-0,6 г):
m(пустой стакан) = г
m(стакан +» 0,4-0,6 г = навеска соли) = г
Осторожно ПЕРЕСЫПАТЬ отвешенную соль через спецворонку в ПОЛУЧЕННУЮ и нумерованную мерную колбочку на 0,1л. Снова взвесить стаканчик с остатками соли:
m(стакан + остатки соли) = г
m(навески) = - =.10-1 г
3. Растворить пересыпанную навеску соли в мерной колбочке на 0,1л, смыв с поверхности спецворонки следы отвешенного вещества.
Объем раствора довести дистиллированной водой до метки мерной колбочки. ПЕРЕМЕШАТЬ! Поставить на рабочее место!
4. Отмерить пипеткой 10 мл приготовленного раствора и внести в стакан на 150-200 мл.
5. Добавить в этот же стакан из общей для группы бюретки 20 мл рабочего раствора NaOH:
V(NaOH)10мл = 2.10-2 л
Сн(NaOH) = 0, н =. 10-1 моль/л
(точную нормальность раствора щелочи в общей бюретке укажет ЛАБОРАНТ)
Общее число моль-эквивалентов добавленной щелочи равно:
nэ(NaOH)10мл = Cн(NaOH). V(NaOH)10мл =. 10-1. 2.10-2 =.10-3 моль
6. Нагревать содержимое стакана на асбестовой сетке плитки
– о полном удалении аммиака (NH3) из горячего раствора в стакане СУДИТЬ по отрицательной реакции ВЛАЖНОЙ фенолфталеиновой бумажки, которая перестанет розоветь, т.е.: прекратится образование ионов ОН-! (NH3 + H2O = NH4OH Û NH4+ + OH- )
7. Стакан с раствором охладить до комнатной температуры
-малым мерным ЦИЛИНДРОМ добавить ≈10 мл дистиллированной воды,
а из капельницы - 3-5 капель ИНДИКАТОРА - метилрот.
8. Титровать получившийся ЖЕЛТЫЙ РАСТВОР в стаканераствором HCl из бюретки
до перехода окрашивания от желтого в устойчивое СЛАБО-РОЗОВОЕ:
V(HCl)10 мл = мл
(Пункты 4-8 повторить до получения 3-х сходимых результатов (≈0,2 мл), их усреднить!):
V(HCl)10 мл (2) = мл,
V(HCl)10 мл (3) = мл,
V(HCl)10 мл (4) = мл,
V(HCl)10 мл (5) = мл,
Среднее арифметическое значение V(HCl)10 мл(среднее) получают делением на 3 суммы из трех выбранных исполнителем УДОВЛЕТВОРЯЮЩИХ его значений = { [ + + + ] / 3}:
V(HCl)10 мл(среднее) = мл
9. Эту величину использовать в расчетных формулах:
Число моль-экв. HCl, израсходованных на нейтрализацию избыточного количества NaOH**
в объеме 10мл отмеренного исходного раствора приготовленной задачи
(HCl + NaOH** = NaCl + H2O) 10мл:
nэ(HCl)10мл = n**э(NaOH)10мл = Cн(HCl). V(HCl)10мл(среднее) = 0,1. V(HCl)10мл(среднее). 10-3 =
= .10-3 моль
Число моль-эквивалентов щелочи n*э(NaOH)10мл, израсходованное на образование NH3,
в объеме 10 мл раствора задачи (NH4Cl + NaOH* (toC)Þ NaCl + H2O + NH3)10мл,
определяется из разности:
n*э(NaOH)10мл = nэ(NaOH)10мл – n**э(NaOH)10мл = nэ(NH3)10мл =
=. 10-3 -. 10-3 =. 10-3 моль
Масса аммиака, содержащегося в аликвоте 10 мл раствора задачи:
m(NH3)10мл = nэ(NH3)10м. Mэ(NH3) = nэ(NH3)10мл. 17 =. 10-3. 17 =. 10-2 г
Масса аммиака, содержащегося в ПОЛНОМ объеме задачи 100 мл:
m(NH3)100мл = 100. m(NH3)10мл / 10 = 10.. 10-2 =. 10-1 г
Массовое процентное содержание аммиака в навеске соли аммония, полученное в опытах:
С%(NH3)опытное = [ m(NH3)100мл / m(навески) ]. 100% = %
Можно воспользоваться резюмирующим равенством:
С%(NH3)опытное = 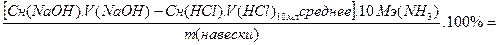
= [ - ]. 17. 1000 / = %
10. Истинное содержание NH3 в соли- узнать у преподавателя по номеру задачи:
Для «чистого» вещества NH4Cl его можно рассчитать по теоретической формуле:
C%(NH3)истиное = [ M(NH3) / M(NH4Cl) ]. 100% = 17. 100 / 53,5 = 31,8%
C%(NH3)истиное = %
11. Относительное отклонение полученного результата от истинного значения:
χ = [ C%(NH3)опытное – С%(NH3)истинное ] 100% / C%(NH3)истинное = %
12. Конспект аккуратно оформленного лабораторного отчета
ПОДПИСЫВАЮТ студент и преподаватель, указав дату выполнения работы и отметив в журнале полученный ПРИЕМЛЕМЫЙ результат, χ ≤5%.
Дата: Подпись студента: Подпись преподавателя:
 2015-08-13
2015-08-13 269
269








