Известно, что если при постоянной температуре повышать давление какого-либо газа, то при достижении определенного давления «тот газ сконденсируется, т. е. перейдет в жидкую фазу. Для каждого газа существует определенная предельная температура, выше которой ни при каком давлении этот газ нельзя перевести в жидкое состояние. Максимальная температура, при которой данный газ •еще может быть переведен в жидкое состояние при повышении давления, называется критической температурой. Например, для метана критическая температура равна — 82,1° С, для этана +32,3° С, для азота +141,7° С.
Давление, соответствующее критической температуре, называется критическим давлением.
В критическом состоянии, или в критической точке, газообразная и жидкая фазы имеют одинаковые свойства. Температура, при которой вещество с повышением давления до определенной величины из газообразной фазы переходит в жидкую, называется точкой росы, или точкой начала кондесации.И, наоборот, эта же температура при снижении давления является точкой начала кипения, или точкой начала испарения, так как при этом вещество из жидкой фазы начинает переходить в газообразную. Так ведут себя индивидуальные химические вещества, в том числе и углеводороды.
Зависимость между давлением и удельным объемом индивидуальных углеводородов приведена на рис. 5. Из кривых рис. 5 видно, что при изотермическом сжатии этана объем его уменьшается с повышением давления до тех пор, пока не появится жидкая фаза. С появлением жидкой фазы сжатие системы происходит при постоянном давлении до полного перехода углеводорода в жидкое состояние. После этого даже небольшие изменения объема жидкого углеводорода приводят к резкому повышению давления.
Кривая АСВ называется граничной кривой. Часть ее А С является линией насыщенной жидкости или точек кипения; другая часть
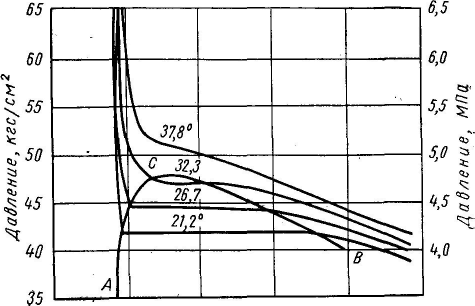 |
СВ — линией насыщенного газа или точек росы (начала конденсации) Влево от линии точек кипения существует только жидка» фаза вправо от линии точек росы — только газовая фаза, а внутри граничной кривой — двухфазная область (жидкая и газовая фазы). По мере увеличения температуры (а следовательно, и давления для данной системы) изотермы пересекаются с кривой точек росы при все меньших значениях удельного объема, а пересечение их с кривой точек кипения происходит при все больших значениях удельного объема, т. е. с повышением температуры минимальный
Рис. 5. Зависимость
«объем — давление»
| 3.5 |
 2015-08-13
2015-08-13 3454
3454
