Ионы меди(I) содержат десять 3d-электронов и обычно образуют четырехкоординированные тетраэдрические структуры типа [CuCl4]3-. Однако с сильно основными высокополяризованными или легко поляризующимися лигандами медь(I) образует двухкоординированные линейные комплексы. Это обстоятельство было объяснено допущением о смешении s - и 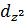 - орбиталей, так как самое низшее состояние d 9 s выше уровня d10 всего лишь на 2,7 эВ. Это дает возможность двум электронам орбитали
- орбиталей, так как самое низшее состояние d 9 s выше уровня d10 всего лишь на 2,7 эВ. Это дает возможность двум электронам орбитали 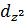 находиться на гибридной орбитали (s –
находиться на гибридной орбитали (s – 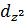 ) перенося заряд с оси z в плоскость ху, что в свою очередь приводит к образованию прочной связи вдоль оси z, при условии, что связь металл—лиганд имеет ярко выраженный ковалентный характер. Другое объяснение заключается в допущении, что если лиганды являются сильными δ-донорами, но слабыми π-акцепторами, то образуются двух-координированные комплексы; если же лиганды сильные π-акцепторы, то образуются четырехкоординированные комплексы и тетраэдрическая конфигурация будет результатом образования сильной обратной донорной связи за счет π-электронов.
) перенося заряд с оси z в плоскость ху, что в свою очередь приводит к образованию прочной связи вдоль оси z, при условии, что связь металл—лиганд имеет ярко выраженный ковалентный характер. Другое объяснение заключается в допущении, что если лиганды являются сильными δ-донорами, но слабыми π-акцепторами, то образуются двух-координированные комплексы; если же лиганды сильные π-акцепторы, то образуются четырехкоординированные комплексы и тетраэдрическая конфигурация будет результатом образования сильной обратной донорной связи за счет π-электронов.
Низкий заряд Cu+ и его Зd10-электронная структура приводят к тому, что Cu(I) образует наиболее прочные комплексы с сильнополяризующимися лигандами, особенно в тех случаях, когда возможно обратное двойное связывание. К известным примерам, используемым в фотометрических методах, относятся производные α, α'-дипиридила и 1,10-фенантролина.
 2015-08-13
2015-08-13 1460
1460








