По степени увеличения параметра расщепления Δ лиганды располагаются в ряд, называемый спектрохимическим (Рис. 2.9).
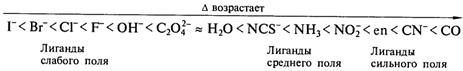
Рис. 2.9. Спектрохимический ряд лигандов
При взаимодействии лиганда сильного поля и ЦА происходит расщепление d- орбитали. В этом случае распределение электронов по правилу Хунда становится невозможным, так как для перехода электронов с более низкого 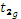 -уровня на более высокий
-уровня на более высокий 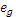 -уровень требуются затраты энергии, что энергетически не выгодно (большое значение параметра расщепления Δ). Потому электроны вначале полностью заполняют
-уровень требуются затраты энергии, что энергетически не выгодно (большое значение параметра расщепления Δ). Потому электроны вначале полностью заполняют 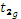 -уровень, а затем только идет заполнение
-уровень, а затем только идет заполнение 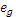 -уровня. В случае нахождения на d- орбитали 6 электронов, под действием лиганда сильного поля, происходит заполнение
-уровня. В случае нахождения на d- орбитали 6 электронов, под действием лиганда сильного поля, происходит заполнение  -уровня со спариванием электронов. При этом создается низкоспиновой диамагнитный комплекс. А в случае лиганда слабого поля, когда параметр расщепления Δ принимает более низкое значение, равномерное распределение электронов по правилу Хунда становится возможным. При этом спаривания всех электронов не происходит, образуется высокоспиновой парамагнитный комплекс.
-уровня со спариванием электронов. При этом создается низкоспиновой диамагнитный комплекс. А в случае лиганда слабого поля, когда параметр расщепления Δ принимает более низкое значение, равномерное распределение электронов по правилу Хунда становится возможным. При этом спаривания всех электронов не происходит, образуется высокоспиновой парамагнитный комплекс.
Последовательность расположения лигандов в спектрохимическом ряду в рамках теории МО можно объяснить следующим образом. Чем больше степень перекрывания исходных орбиталей, тем больше энергетическое различие между связывающими и разрыхляющими орбиталями и тем больше Δ. Иначе говоря, значение Δ растет с усилением σ- связывания металл – лиганд. На значение Δ, кроме того, существенное влияние оказывает π-связывание между ЦА и лигандами.
Если лиганды имеют орбитали (пустые или заполненные), которые по условиям симметрии способны к перекрыванию с dxy-, dxz- и dyz- орбиталями ЦА, то диаграмма МО комплекса существенно усложняется. В этом случае к МО σ- и σ*- типа добавляются молекулярные орбитали π- и π*-типа. Орбитали лигандов, способные к π-перекрыванию, – это, например, p- и d- атомные орбитали или молекулярные π- и π*-орбитали двухъядерных молекул. На Рис. 2.10 показаны сочетания орбиталей лигандов и dxz- орбиталь ЦА, которые по условиям симметрии могут комбинироваться с образованием молекулярных π-орбиталей.
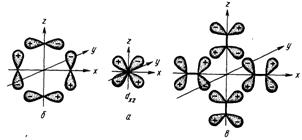
Рис. 2.10. dxz- Орбиталь ЦА (а) и отвечающие ей по симметрии сочетания p – (б) и π* – (в) орбиталей лигандов, приводящие к образованию МО октаэдрического комплекса
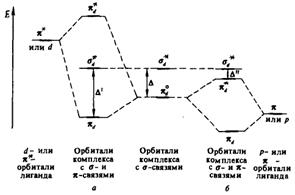
Рис. 2.11. Влияние π-связывания на величину Δ
Участие dxy-, dxz- и dyz- орбиталей в построении π-орбиталей приводит к изменению Δ. В зависимости от соотношения энергетических уровней орбиталей ЦА и комбинируемых с ними орбиталей лигандов значение Δ может увеличиваться или уменьшаться (Рис. 2.11).
При образовании π-орбиталей комплекса часть электронной плотности ЦА переносится к лигандам. Такое π-взаимодействие называется дативным. При образовании π *- орбиталей комплекса некоторая часть электронной плотности от лигандов переносится к ЦА  . В таком случае π-взаимодействие называют донорно-акцепторным.
. В таком случае π-взаимодействие называют донорно-акцепторным.
Лиганды, являющиеся π-акцепторами вызывают большее расщепление d- уровня; лиганды, являющиеся π-донорами, наоборот, вызывают малое расщепление d- уровня. По характеру σ- и π- взаимодействия лиганды можно подразделить на следующие группы.

Сказанное объясняет порядок расположения лигандов в спектрохимическом ряду:
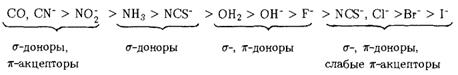 |
В начале этого ряда стоят лиганды сильного поля, в конце – лиганды слабого поля.
Прочность связи. Эта величина коррелирует с энергией стабилизации кристаллическим полем (ЭСКП) – выигрышем энергии за счет заполнения низких по энергии d- уровней относительно нерасщепленных d- орбиталей. В случае комплекса [CoF6]3− энергия стабилизации равна разности между выигрышем за счет электронов, расположенных на 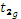 -орбиталях (2/5Δ·4), и проигрышем за счет электронов на
-орбиталях (2/5Δ·4), и проигрышем за счет электронов на 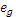 -орбиталях (3/5Δ·2): ЭСКП = 2/5Δо·4 − 3/5Δо·2 = 2/5Δо (или 4 Dq). Для низкоспинового комплекса [Co(NH3)6]3+ энергия стабилизации будет значительно выше, так как в нем все электроны находятся на выгодных орбиталях (
-орбиталях (3/5Δ·2): ЭСКП = 2/5Δо·4 − 3/5Δо·2 = 2/5Δо (или 4 Dq). Для низкоспинового комплекса [Co(NH3)6]3+ энергия стабилизации будет значительно выше, так как в нем все электроны находятся на выгодных орбиталях (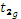 ), однако надо учесть, что при образовании этого комплекса энергия затрачивается еще и на спаривание электронов (2 Р, так как в нем на две электронные пары больше, чем в нерасщепленном состоянии): ЭСКП = 2/5Δо·6 – 2 Р = 12/5 Δо – 2 Р (или 24 Dq – 2 Р).
), однако надо учесть, что при образовании этого комплекса энергия затрачивается еще и на спаривание электронов (2 Р, так как в нем на две электронные пары больше, чем в нерасщепленном состоянии): ЭСКП = 2/5Δо·6 – 2 Р = 12/5 Δо – 2 Р (или 24 Dq – 2 Р).
Магнитные свойства. Для комплексов 3 d- элементов магнитный момент близок к вычисленному по формуле для «чисто спиновой составляющей»: μэфф = 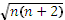 , (3), где n – число неспаренных электронов; μэфф выражается в магнетонах Бора (мБ).
, (3), где n – число неспаренных электронов; μэфф выражается в магнетонах Бора (мБ).
Окраска комплексов/ Большинство комплексов переходных элементов – окрашенные соединения, т.е. они способны поглощать энергию в видимой области спектра (диапазон длин волн от 410 до 720 нм, что соответствует энергии от 290 до 145 кДж/моль). Это объясняется переходом электронов с более низкого на более высокий свободный энергетический уровень, который осуществляется за счет поглощения квантов видимого света. При этом поглощается свет той длины волны, которая соответствует энергии расщепления: ∆0=Е=hc/λ
Видимая окраска соединения соответствует дополнительному цвету, т.е. цвету, который ми видим, если из непрерывного спектра удалены какие-то длины волн. Цвет объясняется спектром поглощения комплекса.
10. Метод молекул.орбиталей(ММО). Взаимодействие центрального атома и лигандов.
Молекулярные орбитали в КС образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах. Отличие заключается лишь в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола.
Метод МО стал в настоящее время ведущим, наиболее плодотворным в теории строения КС. Метод молекулярных орбиталей применительно к координационным соединениям позволяет более строго описать их электронное строение и называется теорией поля лигандов (ТПЛ).
Квантово-механический анализ химической связи КС требует решения уравнения Шредингера
HΨ = EΨ,где Ψ – полная волновая функция (ВФ) системы; Н – оператор Гамильтона; Е – некоторая константа. Т.е. получения функциональной зависимости Ψ от характеристик всех электронов и ядер системы. Известно что эта задача имеет спектральный характер, т.е. решение ее возможно при ряде фиксированных значений Е, которые носят название собственных чисел оператора Н и играют роль квантовых значений энергии системы. Рассмотрим октаэдрический комплекс d -элементов. Система координат взаимного расположения комплексообразователя и лигандов октаэдрического комплекса состава ML6 показана ниже:
Если расположить ЦА в начале координат (М), а лиганды (L) – на осях, то σ -МО могут образовываться при взаимодействии соответствующих орбиталей лиганда с s-, тремя p- и двумя d- (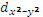 и
и 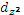 ) орбиталями ЦА, которые направлены к лигандам. Другими словами, молекулярные орбитали образуются при энергетической близости и определенном пространственном соответствии орбиталей взаимодействующих частиц.
) орбиталями ЦА, которые направлены к лигандам. Другими словами, молекулярные орбитали образуются при энергетической близости и определенном пространственном соответствии орбиталей взаимодействующих частиц.
Валентными у d -элементов являются энергетически близкие ns-, np- внешнего и (n-1) d- предвнешнего уровней. Предположим, что у лигандов в образовании связи принимают участие лишь орбитали, которые расположены на осях по направлению к ЦА, а потому по условиям симметрии к π-связыванию они не способны. На Рис. 2.2, а, б показаны возможные комбинации σ- типа валентных орбиталей ЦА и отвечающие им по симметрии сочетания орбиталей лигандов.
Если совместить изображения соответствующей орбитали ЦА и изображения лигандов, то возникнет картина их перекрывания. Как видно на Рис. 2.2, s- орбитали КО благодаря сферической симметрии одинаково перекрываются с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. Это приводит к образованию семицентровых связывающей и разрыхляющей молекулярных σs- орбиталей (и 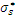 ).
).
Каждая из трех орбиталей p- типа может перекрываться с орбиталями лигандов, расположенных по оси вытянутой гантели. Это отвечает образованию трехцентровых, трех связывающих и трех разрыхляющих σp -орбиталей (σx, σy, σz и 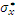 ,
, 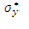 ,
, 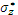 ).
).
Орбитали 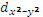 и
и 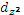 - типа перекрываются с орбиталями лигандов, расположенных по оси вытянутости их лепестков. При этом образуются две связывающие и две разрыхляющие молекулярные σ- орбитали (
- типа перекрываются с орбиталями лигандов, расположенных по оси вытянутости их лепестков. При этом образуются две связывающие и две разрыхляющие молекулярные σ- орбитали (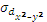 ,
, 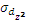 и
и 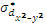 и
и 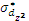 ).
).
Что же касается орбиталей dxy-, dxz-, dyz- типа, то, поскольку их лепестки вытянуты по биссектрисам углов октаэдра, с орбиталями лигандов они не комбинируются (Рис. 2.3). в октаэдрических комплексах без π-связывания они играют роль одноцентровых несвязывающих орбиталей, локализованных при центральном атоме. Их обозначают 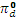 (
(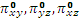 )
)
Энергетическая диаграмма молекулярных орбиталей октаэдрического комплекса [Co(NH3)6]3+. Шесть связывающих МО (σs, σp, σd) локализованы вблизи лигандов, на них находится 12 электронов. Электроны центрального иона занимают несвязывающие dxy, dxz и dyz (t2g) и разрыхляющие 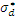 (eg) – орбитали. Разница в энергиях этих орбиталей составляет Δ0.
(eg) – орбитали. Разница в энергиях этих орбиталей составляет Δ0.
Все рассуждения об устойчивости, магнитных свойствах и окраске комплексов, вытекающие из ММО, в основном совпадают с выводами ТКП
 2015-08-12
2015-08-12 4169
4169








