Метод валентных связей (МВС) к комплексным соединениям впервые применил Л. Полинг. он исходил из следующего предположения: связь в комплексном соединении ковалентная и осуществляется по донорно-акцепторному механизму за счет перекрывания вакантных орбиталей центрального атома и заполненных орбиталей лиганда. Геометрия комплексного иона определяется типом гибридизации свободных орбиталей ЦА (Табл. 2.1). Геомет. строение и тип гибр-ции комплекс. ионов
| КЧ | Тип гибридизации | Пространственное строение | Пример |
| sp | Линейное | [Ag(NH3)2]+ | |
| sp2 | Тригональное | [HgI3]− | |
| sp3 | Тетраэдр | [FeBr4]2− | |
| dsp2 | Квадрат | [Ni(СN)4]2− | |
| dsp3, d3sp | Тригональная бипирамида | [CuCl5]3− | |
| d2sp2, d4s | Квадратная пирамида | [Ni(CN)5]3− | |
| d2sp3 | Октаэдр | [Co(NH3)6]3+ | |
| d3sp3 | Пентагональная бипирамида | [V(CN)7]4− | |
| d4sp3 | Квадратная антипризма | [TaF8]3− |
Рассмотрим с этих позиций строение двух комплексов кобальта(III): ионов гексааминокобальта(III) [Co(NH3)6]3+ и гексафторокобальтата(III) [CoF6]3− (Рис. 2.1). Строение ионов [Co(NH3)6]3+ и [CoF6]3− по МВС
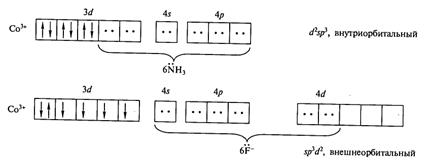
Электронная конфигурация свободного иона Со3+: 3d64s04p04d0. Орбитали иона кобальта, участвующие в образовании связи с ионами F−, гибридизуются с образоваинем sp3d2-гибридных орбиталей (внешнеорбитальный комплекс), что и определяет октаэдрическую конфигурацию комплексного иона [CoF6]3−.
В ионе [Co(NH3)6]3+ реализуется иное распределение электронов по орбиталям – все электроны кобальта спарены. Комплекс также имеет октаэдрическую структуру, но иной тип гибридизации – d2sp3 (внутриорбитальный комплекс). Выбрать одну из этих двух возможных конфигураций можно только, если известны магнитные свойства комплекса. Ион [Co(NH3)6]3+ диамагнитен, все электроны спарены, а ион [CoF6]3− парамагнитен. Определить магнитные свойства комплекса с точки зрения метода валентных связей невозможно, также как и цветность комплекса, и его внутри- или внешнеорбитальность.
Некоторые лиганды или их атомы могут иметь вакантные орбитали, например PH3, H2S. В этом случае образуются дополнительные связи по донорно-акцепторному механизму (дативные связи), в которых лиганд служит акцептором, а комплексообразователь, имеющий неподеленные электронные пары, − донором. Образование дативных связей приводит к увеличению прочности комплексов.
Влияние на величину энергии расщепления природы централ.атома (заряда, радиуса, конфигураци), природы, числа, расположение лигандов. Спектрохимический ряд. Окраска и магнитные свойства комплексов.
Теория кристаллического поля (ТКП) является развитием простой электростатической теории образования комплексов. Она лучше всего применима к соединениям d- элементов и является наиболее простой моделью, позволяющей достаточно просто объяснить их свойства. Согласно теории связь в комплексе осуществляется за счет электростатического взаимодействия между положительно заряженным центральным атомом и отрицательно заряженными лигандами. Лиганд рассматривается только как источник заряда (кристаллического поля), тогда как для центрального атома учитывается пространственное расположение d-орбиталей.
Геометрическое строение комплексно частицы определяется в первом приближении максимальным взаимным отталкиванием отрицательно заряженных лигандов: шесть лигандов образуют октаэдр, четыре – тетраэдр.
В свободном атоме или ионе все пять d- орбиталей одного и того же уровня имеют одинаковую энергию, т.е. они вырождены. Если, гипотетически, ион d- элемента внести в центр сферы равнораспределенного отрицательного заряда, то на все пять электронных облаков будет действовать одинаковая сила отталкивания. В результате этого произойдет возбуждение d- подуровня, но вырождение не снимется. Иная картина возникает, если ион попадает в октаэдрическое, тетраэдрическое или иное окружение (менее симметричное, чем сферическое). Допустим, положительный ион d- элемента находится в октаэдрическом окружении отрицательно заряженных ионов или полярных молекул.
В этом случае 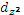 - и
- и 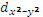 - электроны испытывают большее электростатическое отталкивание от лигандов, чем dxy-, dxz- и dyz- электроны.
- электроны испытывают большее электростатическое отталкивание от лигандов, чем dxy-, dxz- и dyz- электроны.
Следовательно, энергия d- электронов в этих условиях не одинакова: в 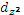 - и
- и 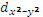 - состоянии (
- состоянии (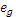 ) энергия выше, чем в dxy-, dxz- и dyz- состоянии (
) энергия выше, чем в dxy-, dxz- и dyz- состоянии (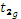 ). Таким образом, если в свободном или находящемся в сферическом поле ионе пять d- орбиталей имеют одинаковую энергию, то в октаэдрическом поле лигандов они разделяются на две группы с разными энергиями – в три и две орбитали.
). Таким образом, если в свободном или находящемся в сферическом поле ионе пять d- орбиталей имеют одинаковую энергию, то в октаэдрическом поле лигандов они разделяются на две группы с разными энергиями – в три и две орбитали.
Энергетическая разность d- уровней Δ называется энергией расщепления кристаллическим полем. Она выражается в единицах Dq (мера силы кристаллического поля), причем Δ Е = Е1 – Е2 = 10Dq= Δ. Для октаэдрического комплекса энергия 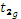 -орбиталей на 2/5Δ (4 Dq) ниже вырожденных d- орбиталей, а
-орбиталей на 2/5Δ (4 Dq) ниже вырожденных d- орбиталей, а 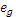 − на 3/5Δ (6 Dq) выше.
− на 3/5Δ (6 Dq) выше.
Величина энергии расщепления определяет свойства КС, поэтому важно знать факторы, от которых она зависит.
 2015-08-12
2015-08-12 5365
5365
