По способу фиксирования ТЭ выделяют методы титрования с цветными индикаторами, методы потенциометрического, кондуктометрического, фотометрического титр-я и т д. При классификации по типу основной р-ции:1) Методы кислотно-основного взаимодействия связаны с процессом передачи протона: Н+ + ОН- = Н2О; СНЗСООН + ОН- = СНЗСОО- + Н2О. 2)Методы комплексообразования (комплексонометрии), используют р-ции образования координационных соед-ий: Мg2++Н2Y2-= МgY2-+2Н+; Нg2++2Сl-=НgСl2 (меркуриметрия). 3)Методы осаждения основаны на р-циях образования малорастворимых соединений: Аg++Cl-=АgСl (аргентометрия). 4)Методы окисления—восстановления объединяют многочисленную группу Red-Ox р-ций: МnO4- + 5Fe2+ + 8Н+ = Мn2+ + 5Fе3+ + 4Н2О (перманганатомерия); 2S2O32- + I2 = S4O62- + 2I-(иодометрия). Расчет результатов ТА основан на принципе эквивалентности. В-ва реагируют м/у собой в эквивалентных кол-вах. Фактор эквивалентности - число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода/протону в данной кислотно-основной реакции или одному электрону в данной ОВР:
νАА+ νВВ→Продукты; fэкв(B)=νВ/νА(νА>νВ); fэкв ≤ 1.
Эквивалент - условная частица, которая может присоединять, отдавать или каким-л. др. способом быть эквивалентна одному протону в кислотно-основной реакции или одному электрону в ОВР: (νВ/νА)*В – эквивалент в-ва В. Под условной ч-цей понимают как реально существующие ч-цы, так и доли этих ч-ц. Н., ½ мол-лы или 1/5 иона. fэкв и эквивалент в-ва не являются постоянными величинами и зависят от стехиометрии р-ций, в которых это в-во принимает участие. Н.:
MnO4-+8H++5e↔Mn2++4H2O, fэкв(MnO4-)=1/5;
MnO4-+4H++3e↔MnO2+2H2O, fэкв(MnO4-)=1/3.
В общем случае Мэ(Х)=fэкв(Х)*М(Х).
Нормальный р-р (н) – р-р, содержащий 1 моль эквивалентов в-ва в 1л. Расчет результатов прямого титр-я. N1V1=N2V2; m1(г)=(N2V2/1000)*М1. Если титрование проводят из аликвотных частей, то полученный результат умножают на фактор аликвотирования fa. Абс. погрешность определения массы: (Sm/m)=[(Sc/c)2-(Sv/V)2+(Sк/Vк)2+ (Sп/Vп)2]1/2, где Sc-абс. погрешность взятия навески; Sv-абс. погреш. определения объема титранта; Sк-/-/-мерной колбы; Sп-/-/ пипетки. Поправочный коэф. К=Сист/Стабл. Усл. титр титранта-какому кол-ву титруемого в-ва (в г) соответствует 1 мл титранта. Т(1/2)=С1*М2/1000; m1=T(1/2)*K*V1.
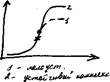
Кривые титрования строят в координатах: конц-я компонента или lg C или другое св-во титруемого р-ра от объема р-ра титранта или степени оттитрованности (Vзатрач.титранта/Vэ,титранта).
Различают теоретические и экспериментальные кривые титрования: теор. – рассчитывают на основании констант равновесия и концентраций компонентов, используют для обоснования и выбора индикатора; эксп. - строят при использовании физико-химических способов индикации ТЭ (pH, Q, А) и строят график зависимости этого св-ва от V.
Общий вид р-ций в основе титриметрических методов: Х+R↔ХR, где X-определяемый компонент, R-титрант, XR-продукт. Титрование проводят до ТЭ, когда достигнуто эквивалентное соотношение реагирующих в-тв. ТЭ: [Х]=[R]. До ТЭ [Х]>[К], после ТЭ [Х]<[К.]. Индикатор выбирается по точке перегиба на кривой титрования. Ошибка титрования тем меньше, чем больше скачек на кривой титрования. Кривые титрования. Для кислотно-основного титро-вания скачок зависит от начальной конц-ии реагиру-ющих компонентов, чем они выше, тем скачок больше и выше точность (рис а). Лучшие результаты при титровании сильных протолитов, поэтому титрант дб сильным. В методе комплексообразования лучшие результаты получаются, если образуется комплексное соединение, характеризующееся высокой прочностью (рис б). В методе осаждения - при образовании наименее растворимого соединения. Наличие побочных р-ций уменьшает скачек в комплексонометрии (рис в). Чем больше разность стандарт. потенциалов, тем больше константа рав-новесия и тем больше скачек титр-я. В мето-де ОВР лучшие резуль-таты при сильных окис-лях и восстан-лях. Индикаторы для кисл.-основ. титр-я предст-ют собой слабые к-ты и осн-я, у которых одна форма окрашена, а др. б/цв. или обе формы окрашены в разные цвета (м/о, ф/ф, бромтимоловый синий), индикатор выступает как 2-я к-та или осн-ие, он титр-ся после осн-ого протолита, т.к. явл-ся более слабым, кроме того его конц-ия знач-но ниже конц-ии осн-ого протолита. У правильно выбранного индикатора


 2015-08-12
2015-08-12 684
684







