1. реакция Гриньяра
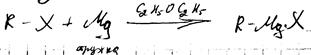
Механизм
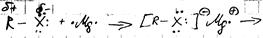
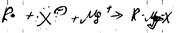
Свойства:
1. с протонодонорными соед-ями
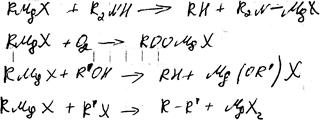
2. с карбонильными
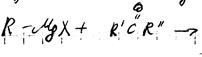
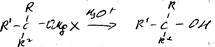
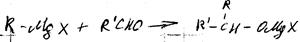
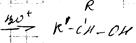
3. с углекислым газом
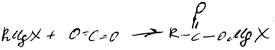
65.Влияние заместителей. Нуклеофильное замещение в ароматическом и
гетероароматическом ряду.
Реакции нуклеофильного замещения (англ. nucleophilic substitution reaction) — реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг.
Все нуклеофилы являются основаниями Льюиса.
Общий вид реакций нуклеофильного замещения:
R−X + Y− → R−Y + X− (где Y− анионный нуклеофил)
R−X + Y−Z → R−Y + X−Z (где Y−Z нейтральный нуклеофил)
Выделяют реакции алифатического (широко распространены) и ароматического (мало распространены) нуклеофильного замещения.
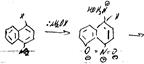
Гетероароматический ряд
 если положение 2 занято то в 4.
если положение 2 занято то в 4.
Механизм:
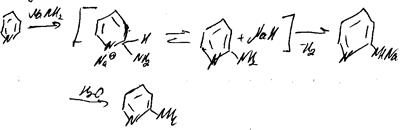
66. Бимолекулярный механизм. Механизм элиминирования-присоединения.
Примеры реакций.
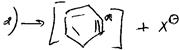
двухстадийный бимолекулярный механизм AdN2: вначаленуклеофил медленно присоединяется по кратной связи с образованием карбаниона, который на второй стадии быстро атакует электрофильная частица[3].
1) механизм элиминирования присоединения
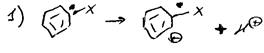
Бирадикал:

2) SN2ар: где A-акцепторная группа, Nu= OH–, RO–, NH2–.
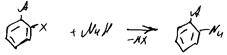
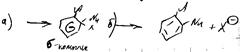
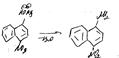
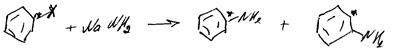
67.Нуклеофильное замещение в алифатическом ряду. Механизмы SN1, SN2. Амбидентный ион. Примеры реакций.
Происходит взаимодействие орг. соединения у которого есть дефицит электронной плотности на атоме углерода, связанном с электроноакцепторной группой Х, с соединением или анионом в состав которого входит атом с неподеленной парой е на внешней оболочке. В результате такого вз-вия происходит образование новой связи м/у нуклеофилом и электродефере атомом углерода
Nu: R3N:,;NH3, R:NH2; H2O, R3P,RO(-)M(+); HalM; арены; BH4M.
SN1: CH2=CH-CH2Cl=>CH2=CH-CH2=>CH2=CHCH2Nu; а) диссоциация (лимитирующая) СH2=CH-CH2Cl=>CH2=CH-CH2+; б) CH2=CH-CH2++Nu=>CH2=CHCH2Nu
SN2:
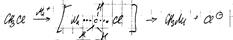
Интермедиан. Атака нуклеифилом с тыла.
Первичные галоген производное реагируют по SN2, вторичные-SN1 или SN2, третичные по SN1.
Примеры:
1)RX+H2O=>ROH+HX; 2)RX+NaOR1=>ROR1+NaX; 3)2RX+2NaCN=> RCN+RNC+2NaX;
АМБИДЕНТНЫЕ СОЕДИНЕНИЯ- (амбифункциональные соединения), имеют два реакционных центра, связанных в единую мезомерную (сопряженную) систему. Соед., имеющие неск. таких центров, наз. полидентными.
Наиб. важная группа А. с. - амбидентные анионы: енолятионы моно- и 1,3-дикарбонильных соед., аллил-анионы, анионы нитроалканов, гетероциклич. соединений ряда пиррола и индола, цианид- и тиоцианат - ионы и др. Особая подгруппа - анионы, к-рые имеют атом с неподеленной парой электронов, не принимающей участие в сопряжении, напр. нитрит-, оксимат-, диазотат- и сулифинат - ионы.
68. Клетка — элементарная единица структуры, функции и развития живой материи, которая характеризуется подразделением на ядро (или нуклеоид), цитоплазму и клеточную мембрану и обладает всем комплексом свойств живого: самовоспроизведением, саморазвитием (ростом), саморегуляцией, обменом веществ и энергии, раздражимостью, подвижностью, адаптацией и способностью противостоять энтропии.
Все организмы, имеющие клеточное строение, делятся на две группы: предъядерные (прокариоты) и ядерные (эукариоты).
Клетки прокариот, к которым относятся бактерии, в отличие от эукариот, имеют относительно простое строение. В прокариотической клетке нет организованного ядра, в ней содержится только одна хромосома, которая не отделена от остальной части клетки мембраной, а лежит непосредственно в цитоплазме. Однако в ней также записана вся наследственная информация бактериальной клетки.
Цитоплазма прокариот по сравнению с цитоплазмой эука-риотических клеток значительно беднее по составу структур. Там находятся многочисленные более мелкие, чем в клетках эукариот, рибосомы. Функциональную роль митохондрий и хло-ропластов в клетках прокариот выполняют специальные, довольно просто организованные мембранные складки.
Клетки прокариот, так же как и эукариотические клетки, покрыты плазматической мембраной, поверх которой располагается клеточная оболочка или слизистая капсула. Несмотря на относительную простоту, прокариоты являются типичными независимыми клетками.
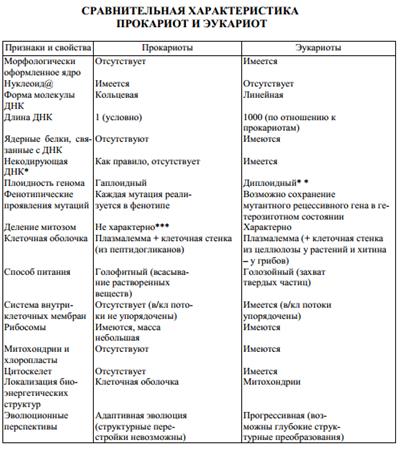
Сравнительная характеристика клеток эукариот. По строению различные эукариотические клетки сходны. Но наряду со сходством между клетками организмов различных царств живой природы имеются заметные отличия. Они касаются как структурных, так и биохимических особенностей.
Для растительной клетки характерно наличие различных пластид, крупной центральной вакуоли, которая иногда отодвигает ядро к периферии, а также расположенной снаружи плазматической мембраны клеточной стенки, состоящей из целлюлозы. В клетках высших растений в клеточном центре отсутствует центриоль, встречающаяся только у водорослей. Резервным питательным углеводом в клетках растений является крахмал.
В клетках представителей царства грибов клеточная стенка обычно состоит из хитина - вещества, из которого построен наружный скелет членистоногих животных. Имеется центральная вакуоль, отсутствуют пластиды. Только у некоторых грибов в клеточном центре встречается центриоль. Запасным углеводом в клетках грибов является гликоген.
В клетках животных отсутствует плотная клеточная стенка, нет пластид. Нет в животной клетке и центральной вакуоли. Центриоль характерна для клеточного центра животных клеток. Резервным углеводом в клетках животных также является гликоген.
69. Белки, протеины, высокомолекулярные природные органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Именно Б. (ферменты и др.) осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями.


Уровни организации. К. Линдстрём-Ланг предложил выделять 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры.
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали;
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,34 нм на аминокислотный остаток[26]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
70. Витами́ны (от лат. vita — «жизнь») — группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная по химической природе группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи. Автотрофные организмы также нуждаются в витаминах, получая их либо путём синтеза, либо из окружающей среды. К витаминам не относятмикроэлементы и незаменимые аминокислоты
Витамины условно обозначаются буквами латинского алфавита: A,B, C, D, E, H, K и т. д. Впоследствии выяснилось, что некоторые из них являются не самостоятельными веществами, а комплексом отдельных витаминов. Так, например, хорошо изучены витамины группы В. Названия витаминов по мере их изучения претерпевали изменения. Современные названия витаминов приняты в 1956 г. Комиссией по номенклатуре биохимической секции Международного союза по чистой и прикладной химии. До настоящего времени классификация витаминов строилась, исходя из растворимости их в воде или жирах. Поэтому первую группу составляли водорастворимые витамины (C, P и вся группа B), а вторую — жирорастворимые витамины — липовитамины (A, D, E, K). Однако ещё в 1942—1943 гг. академик А. В. Палладин синтезировал водорастворимый аналог витамина К — викасол. А за последнее время получены водорастворимые препараты и других витаминов этой группы. Таким образом, деление витаминов на водо- и жирорастворимые до некоторой степени теряет свое значение.
Водорастворимые витамины в тканях не накапливаются (за исключением витамина В12) и поэтому должны поступать в организм ежедневно. В организме большинство из них активируется путем фосфорилирования. Активные формы в качестве коферментов участвуют в реакциях метаболизма.Жирорастворимые витамины способны накапливаться в тканях. Их недостаточность встречается реже. При передозировке витамины А и Д проявляют токсичность. Коферментная функция (за исключением витамина К) для них не характерна. Выполняя функцию индукторов синтеза белков, жирорастворимые витамины уподобляются стероидным гормонам (ярко выраженную гормональную активность проявляют активные формы витамина Д). Все жирорастворимые витамины являются структурными компонентами клеточных мембран и проявляют антиоксидантное действие.
71.





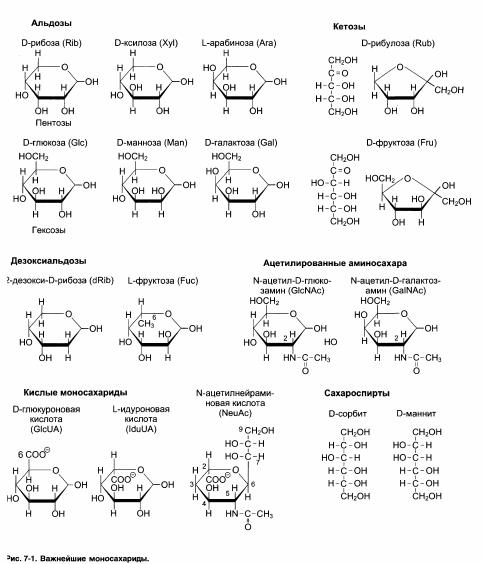
72. Полисахариды – это углеводы, состоящие из большого числа мономерных звеньев, которые соединены между собой гликозидными связями. Они являются высокомолекулярными соединениями, построенными по принципу поликонденсации. Нередко полисахариды имеют в своем составе заместители неуглеводной природы – остатки серной, фосфорной или органических кислот. Все полисахариды делятся на два больших класса:
1. Гомополисахариды построены из остатков только одного вида моносахаридов. Среди них в зависимости от названия моносахарида, являющегося мономерной единицей, различают глюканы, маннаны, галактаны, ксиланы и т. д.
2. Гетерополисахариды построены из остатков двух и более различных моносахаридов. Иногда для гетерополисахаридов, построенных из двух типов мономеров, названия составляют смешением имен исходных моносахаридов. Например, продуктом конденсации арабинозы и галактозы будут арабиногалактаны, глюкозы и маннозы – глюкоманнаны и т. д.
Однако любой образец полисахарида в строгом смысле слова не гомогенен, а представляет собой смесь полимергомологов.
В природе полисахариды составляют главную массу органического вещества биосферы. Они выполняют в живых организмах важнейшие функции: структурные полисахариды придают клеточным стенкам прочность, водорастворимые полисахариды не дают клеткам высохнуть, резервные полисахариды по мере необходимости расщепляются на моносахариды и используются организмом, выступая в роли энергетического резерва.
ГЛИКОЗИДЫ (от греч. glykys-сладкий и eidos-вид), соед., в к-рых остаток циклич. формы моно- или олигосахарида (гликозильный, или углеводный, остаток) связан с др. орг. остатком (агликоном) через гетероатом; соотв. различают О-, N-, S-гликозиды и др. Связь между гликозильным остатком и агликоном наз. гликозидной. При образовании гликозидов возникает новый асимметрич. гликозидный центр. Его конфигурацию обозначаютили в зависимости от того, совпадает она или нет с конфигурацией того углеродного атома моносахарида, к-рый определяет принадлежность последнего к D- или L-ряду. Напр., в изомерных метил-О-глюкопиранозидах конфигурация отражается ф-лой I, конфигурация-ф-лой II: 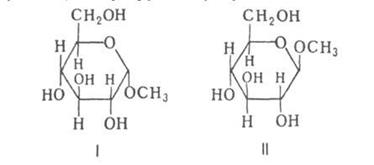
По размеру цикла углеводного остатка гликозиды делят на фуранозиды (5-членные), пиранозиды (6-) и септанозиды. (7-); по числу моносахаридных остатков в углеводной части молекулы - на моноозиды, биозиды, триозиды и олигозиды (соотв. производные моно-, ди-, три- и олигосахаридов).
Гидролиз полисахаридов происходит в разбавленных растворах минеральных кислот (или под действием ферментов). При этом в макромолекулах разрываются связи, соединяющие моносахаридные звенья - гликозидные связи (аналогично гидролизу дисахаридов). Реакция гидролиза полисахаридов является обратной процессу их образования из моносахаридов.
Полный гидролиз полисахаридов приводит к образованию моносахаридов (целюллоза, крахмал и гликоген гидролизуются до глюкозы):
(C6H10O5)n + nH2O (H+) nC6H12O6
При неполном гидролизе образуются олигосахариды (в том числе, дисахариды).
Особенно специфичен ферментативный гидролиз полисахаридов. Ферменты, каталитически ускоряющие гидролиз полисахаридов (носящие общее название карбогидраз), действуют строго избирательно, например только на α-гликозидную связь (α-гликозидазы) или только на β-гликозидную связь (β-гликозидазы). Избирательность действия карбогидраз зависит также от ряда других, более тонких особенностей структуры полисахарида. Так, например, некоторые ферменты вызывают гидролиз только тех гликозидных связей, которые находятся на определенном по счету месте от конца полигликозидной цепи (известны карбогидразы, гидролизующие каждую вторую гликозидную связь, каждую пятую или каждую шестую гликозидную связь). В связи с избирательным действием карбогидраз ферментативный гидролиз полисахаридов является важным методом изучения их строения.
73. Жиры, органические соединения, полные сложные эфиры глицерина (триглицериды) и одноосновных жирных кислот; входят в класс липидов. Наряду с углеводами и белками Ж. — один из главных компонентов клеток животных, растений и микроорганизмов. Строение Ж. отвечает общей формуле:
CH2-O-CO-R’,CH-О-CO-R’’,CH2-O-CO-R’’’где R’, R’’ и R’’’ — радикалы жирных кислот.
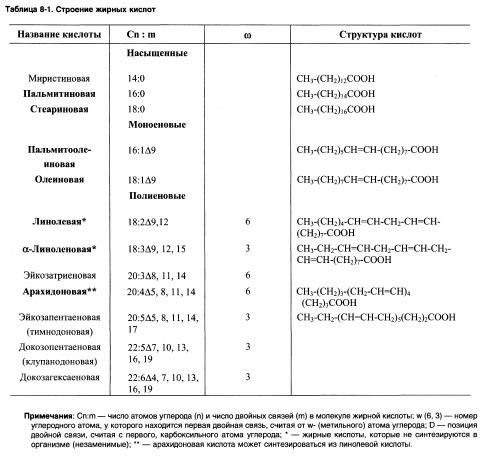


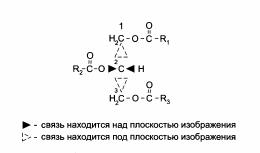

Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло).
С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
74. Нуклеотиды являются сложными эфирами нуклеозидов и фосфорных кислот. Нуклеозиды, в свою очередь, являются N-гликозидами, содержащими гетероциклический фрагмент, связанный через атом азота с C-1 атомом остатка сахара. В природе наиболее распространены нуклеотиды, являющиеся β-N-гликозидами пуринов или пиримидинов и пентоз — D-рибозы или D-2-дезоксирибозы. В зависимости от структуры пентозы различают рибонуклеотиды и дезоксирибонуклеотиды, которые являются мономерами молекул сложных биологических полимеров (полинуклеотидов) — соответственно РНК или ДНК.
Фосфатный остаток в нуклеотидах обычно образует сложноэфирную связь с 2'-, 3'- или 5'-гидроксильными группами рибонуклеозидов, в случае 2'-дезоксинуклеозидов этерифицируются 3'- или 5'-гидроксильные группы.
Большинство нуклеотидов являются моноэфирами ортофосфорной кислоты, однако известны и диэфиры нуклеотидов, в которых этерифицированы два гидроксильных остатка — например, циклические нуклеотиды циклоаденин- и циклогуанин монофосфаты (цАМФ и цГМФ). Наряду с нуклеотидами — эфирами ортофосфорной кислоты (монофосфатами) в природе также распространены и моно- и диэфиры пирофосфорной кислоты (дифосфаты, например, аденозиндифосфат) и моноэфиры триполифосфорной кислоты (трифосфаты, например, аденозинтрифосфат).
В каждом живом организме присутствуют 2 типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). Молекулярная масса самой "маленькой" из известных нуклеиновых кислот - транспортной РНК (тРНК) составляет примерно 25 кД. ДНК - наиболее крупные полимерные молекулы; их молекулярная масса варьирует от 1 000 до 1 000 000 кД. ДНК и РНК состоят из мономерных единиц - нуклеотидов, поэтому нуклеиновые кислоты называют полинуклеотидами.
А. Строение нуклеотидов
Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ) (рис. 4-1).
В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Нумерация атомов в основаниях записывается внутри цикла (рис. 4-2). Номенклатура нуклеотидов приведена в табл. 4-1.
Пентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Чтобы отличить номера атомов в пентозах от нумерации атомов в основаниях, запись производят с внешней стороны цикла и к цифре добавляют штрих (') - 1', 2', 3', 4' и 5' (рис. 4-3).
Пентозу соединяет с основанием N-гликозидная связь, образованная С1-атомом пентозы (рибозы или дезоксирибозы) и N1 -атомом пиримидина или N9-aтомом пурина (рис. 4-4).
Нуклеотиды, в которых пентоза представлена рибозой, называют рибонуклеотидами, а нуклеиновые кислоты, построенные из рибонуклеотидов, - рибонуклеиновыми кислотами, или РНК. Нуклеиновые кислоты, в мономеры которых входит дезоксирибоза, называют дезоксири-бонуклеиновыми кислотами, или ДНК. Нуклеиновые кислоты по своему строению относят к классу линейных полимеров. 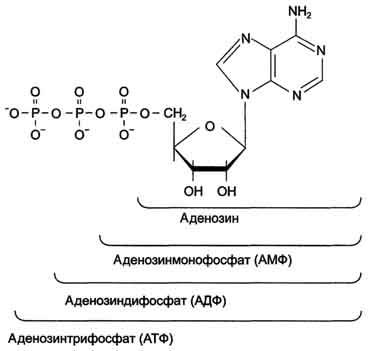
Рис. 4-1. Нуклеозидмоно-, ди- и трифосфаты аденозина. Нуклеотиды - фосфорные эфиры нуклеозидов. Остаток фосфорной кислоты присоединён к 5'-углеродному атому пентозы (5'-фосфоэфирная связь).
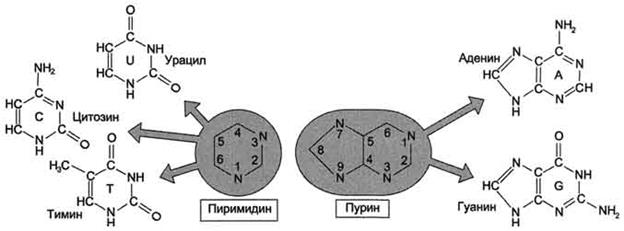
Рис. 4-2. Пуриновые и пиримидиновые основания.
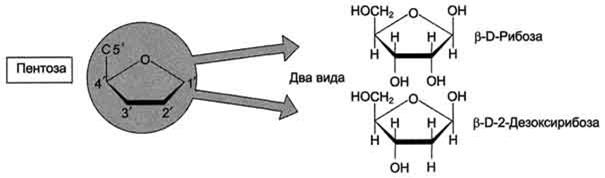
Рис. 4-3. Пентозы. Присутствуют 2 вида - β-D-рибоза в составе нуклеотидов РНК и β-D-2-дезоксирибоза в составе нуклеотидов ДНК.
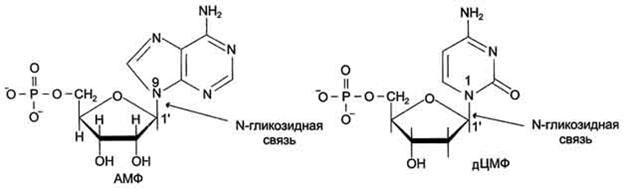
Рис. 4-4. Пуриновый и пиримидиновый нуклеотиды
Соединения, состоящие из двух нуклеотидовых молекул, называются динуклеотидами, из трёх — тринуклеотидами, из небольшого числа — олигонуклеотидами, а из многих — полинуклеотидами, или нуклеиновыми кислотами.
Названия нуклеотидов представляют собой аббревиатуры в виде стандартных трёх- или четырёхбуквенных кодов.
Если аббревиатура начинается со строчной буквы «д» (англ. d), значит подразумевается дезоксирибонуклеотид; отсутствие буквы «д» означает рибонуклеотид. Если аббревиатура начинается со строчной буквы «ц» (англ. c), значит речь идёт о циклической форме нуклеотида (например, цАМФ).
Первая прописная буква аббревиатуры указывает на конкретное азотистое основание или группу возможных нуклеиновых оснований, вторая буква — на количество остатков фосфорной кислоты в структуре (М — моно-, Д — ди-, Т — три-), а третья прописная буква — всегда буква Ф («-фосфат»; англ. P).
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения. Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций: Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот. Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность. АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала. Также известна роль АТФ в качестве медиатора в синапсах. 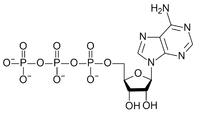
НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ
НАДФ присутствующий во всех живых клетках кофермент ферментов группы дегидрогеназ, катализирующих важнейшие окислит.-восстановит, реакции энергетич. и пластич. обмена. Отличается от НАД наличием третьего остатка фосфорной к-ты при С2 рибозы аденинового нуклеотида. В клетках Н. присутствует в осн. в восстановленной форме (НАДФ-Н). Окисленный Н. (НАДФ+) — акцептор водорода при окислении глюкозо-6-фосфата в пентозном цикле,- в световых реакциях фотосинтеза и т. д. Восстановленный Н. используется гл. обр. в биосинтезах жирных к-т, углеводов (в темновых реакциях фотосинтеза), восстановительном аминировании а-кетоглутаровой к-ты. При действии специфич. НАДФ-цитохромредуктазы происходит прямое окисление Н. в дыхат. цепи. Биосинтез Н. осуществляется при фосфорилировании НАД ферментом НАД-кииазой.
флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. Соединения рибофлавина с фосфорной кислотой являются флавиновыми коферментами, входящими в состав каталитических центров важнейших окислительно-восстановительных ферментов-флавиновых оксиредуктаз или флавопротеидов. Эти ферменты принимают участие в окислении жирных кислот, окислительном декарбоксилировании пировиноградной кислоты и кетоглутаровой кислоты, в цикле трикарбоновых кислот, в окислительном фосфорилировании. Таким образом, флавиновые ферменты занимают одно из центральных мест в процессах энергетического обмена.
 2015-08-12
2015-08-12 2111
2111
