В большинстве случаев посторонние примеси снижают интенсивность люминесценции. Причиной этого являются как физические, так и химические процессы. В результате химического воздействия может возникнуть новое соединение, не обладающее люминесценцией. Наряду с этим молекулы (атомы) могут участвовать в соударениях с возбужденными молекулами определяемого вещества, в результате чего происходит безизлучательное рассеяние энергии.
Практическое применение
В практике люминесцентных методов значительное место занимает анализ обнаружения. По люминесценции фосфоров и других веществ обнаруживают инфракрасное, ультрафиолетовое, рентгеновское и γ-излучение, регистрирует потоки протонов, электронов, и α-частицы. Известны люминесцентные способы диагностики различных заболеваний. В оптико-механической промышленности люминесцентный анализ обнаружения используют для маркировки различных сортов стекла, в резиновой промышленности для контроля состава шихты, в бумажной - для установления качества целлюлозы, в алмазодобывающей промышленности по характерному свечению отбирают алмазы и т.д.
Методы люминесцентного анализа успешно используют в анализе лантаноидов, соединений урана и ряда других элементов. Люминесцентной способностью обладают многие органические соединения: бензол, нафталин и их многочисленные производные, биологически активные вещества (витамины, антибиотики, гормоны), многие пигменты и т.д. Благодаря низкому пределу обнаружения и простоте применяемой аппаратуры люминесцентный анализ успешно развивается и является одним из перспективных методов.
Общая характеристика метода
Важнейшей особенностью люминесцентного метода анализа является его применяемость к определению микропримесей. Погрешность метода составляет 5...7%. Применимость люминесцентного анализа очень широка. Он может быть использован для определения почти любого элемента, многих органических, биологически активных и других веществ.
Задание к лабораторной работе.
Цель работы: определение содержания рибофлавина (витамина В2) в контрольном растворе.
Приборы и оборудование: исходный раствор рибофлавина С = 1,6 мкг/мл, 4 колбы, 4 бюретки, регистрирующий спектрофотометр СФ -10, флуориметр ЭФ-ЗМА.
Методика определения
1. На регистрирующем спектрофотометре СФ -10 записывают спектр поглощения рибофлавина (1,6 мкг/мл).
2. Используя правило зеркальной симметрии Левшина строят на той же самой диаграммной ленте спектрофотометра спектр люминесценции рибофлавина. Для этого, используя значение λ0=494 нм (λ0 - точка пересечения спектров поглощения и люминесценции), опускают на ось абсцисс перпендикуляр в точку λ0. В спектре поглощения находят λпоглощмакс и затем определяют λлюммакс, зеркально симметричный λпоглощмакс, далее графически строят спектр флуоресценции, зеркально симметричный спектру поглощения относительно прямой?ч. Для графического построения спектра флуоресценции, необходимо подобрать масштаб спектра по оси ординат так, чтобы максимумы спектров поглощения и спектров флуоресценции имели равные высоты.
3. Определив λпоглощмакс и λлюммакс, выбирают соответственно первичные и вторичные светофильтры.
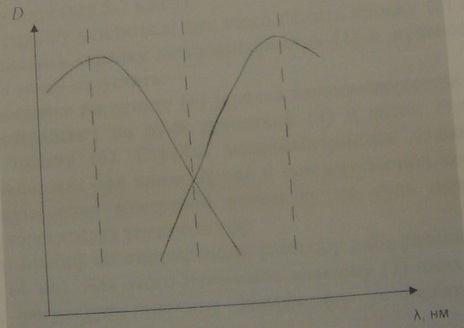
Приготовление растворов для построения калибровочного графика.
1. В четыре чистые и сухие колбы приливают из бюреток следующие количества рибофлавина (1,6 мкг/мл) и дистиллированной воды:
Приготовленные растворы(объёмы растворов – 15 мл):
1) 3 мл рибофлавина + 12 мл дистиллированной воды.
2) 4 мл рибофлавина + 11 мл дистиллированной воды.
3) 5 мл рибофлавина + 10 мл дистиллированной воды.
4) 6 мл рибофлавина + 9 мл дистиллированной воды.
2. Растворы тщательно перемешивают, переливают в измерительные пробирки и измеряют интенсивность люминесценции, при этом номер пробирки должен соответствовать номеру колбы-смесителя. Штатив с пробирками до измерения ставят в шкаф для защиты от действия света на 15 мин.
Техника работы па флуориметре ЭФ-ЗМА
1. Включить прибор в сеть на 220 В.
2. Установить в гнезда (4) и (8) «КЛ» выбранные первичный и два вторичных светофильтра (см. выше).
3. Установить в гнездо (6) «КЛ» измерительную пробирку №4 со стандартным раствором рибофлавина наибольшей концентрации (4 мл) и закрыть ее колпачком.
4. Тумблером (6) включить питание прибора, должна загореться лампочка (8). Проверить визуально включилась ли ртутная лампа.
5. Дать прибору согреться 5-7 минут.
6. Провести настройку усилителя; для этого нажать кнопку (2) и в нажатом состоянии установить стрелку микроамперметра (1) в нулевое положение рукояткой (3). Кнопку отпустить.
7. Если при настройке по пункту (6) стрелка микроамперметра отклонилась от нуля, ее возвращают на нуль рукояткой (4) и затем снова проводят настройку по пункту (6). Стрелка микроамперметра должна сохранять нулевое положение как при нажатой, так и при опущенной кнопке (2). При дальнейшем проведении измерении установку на нуль шкалы проводят рукояткой (4), корректируя темновой ток.
8. Настраивают прибор по стандартному раствору рибофлавина наибольшей
концентрации (4 мл). Для этого нажимают клавишу (7) вниз и с помощью рукоятки (5), регулируя величину диафрагмы, устанавливают стрелку микроамперметра на 80-90 делений.
9. Вынимают пробирку 4, помещают в измерительную камеру последовательно пробирки 1,2,3 и 5 и измеряют интенсивность люминесценции растворов. Результаты заносят в таблицу 2. Измерение каждого раствора проводят дважды.
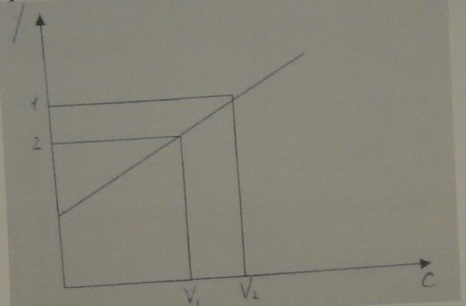
10. По результатам измерения интенсивности люминесценции стандартных растворов рибофлавина 1,2,3 и 4 строят калибровочный график зависимости интенсивности люминесценции - IЛ от объема стандартного раствора рибофлавина, мм.
11. По калибровочному графику определяют содержание рибофлавина в контрольном растворе (пробирка 5).
Следует отметить, что флуориметр после включения может работать не более 30 минут, после чего его необходимо выключить для охлаждения.
 2015-08-21
2015-08-21 1081
1081








