Основными химическими реакциями, в которых участвует бензольное кольцо, являются замещение, присоединение и окисление. Учитывая строение ароматических углеводородов, следует отметить, что для них наиболее характерными будут реакции электрофильного замещения.
1. Реакции электрофильного замещения. К ним относятся реакции галогенирования, нитрования, сульфирования, реакции алкилирования и ацилирования (реакции Фриделя-Крафтса) и др. Все они протекают практически по одному механизму.
Первой стадией электрофильного замещения в ароматическом ряду является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с положительно заряженной частицей Х+. При этом атакующая частица связывается со всеми шестью π-электронами кольца.
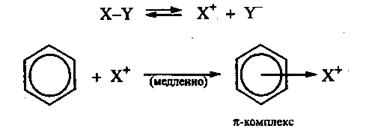
Вторая стадия состоит в переходе π-комплекса в σ-комплекс. Это происходит в результате выделения из шести π-электронов двух для образования новой ковалентной связи С-Х. Оставшиеся четыре π-электрона распределяются между пятью углеродными атомам бензольного кольца. Образовавшийся σ-комплекс удобнее изображать в виде пентадиенильного катиона, граничные (резонансные) структуры которого имеют вид
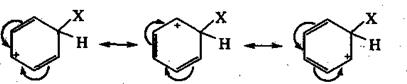
σ-Комплекс — промежуточный неустойчивый катион, лишенный ароматической структуры. Шесть его углеродных атомов пребывают в различных валентных состояниях: один, с которым связан заместитель X, переходит в состояние sр3-гибридизации, приобретая тетраэдрическую симметрию, а пять других находятся в обычном для бензола втором валентном состоянии (sр2). Заместитель X и атом водорода при насыщенном углеродном атоме расположены в плоскости, перпендикулярной плоскости бензольного кольца.
Третья стадия — быстрое отщепление протона от σ-комплекса. Освобождающаяся при этом пара электронов восполняет электронный дефицит в кольце и углерод из состояния sр3 возвращается в состояние sp2-гибридизации
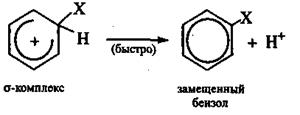
Уходящий протон связывается с анионом Y-

Если в бензольное кольцо ввести хотя бы один заместителей, то оно становится частично поляризованным и место вхождения второго заместителя будет определяться характером и природой первого заместителя.
Заместители, связанные с бензольным кольцом, по своему ориентирующему влиянию на вновь входящие заместители делят на две группы.
1. Заместители (ориентанты) первого рода: -R, -OH, -OR, -OCOR, -SH, -SR, -CH2R, -CR3, -NH2, -NHCOR, -NHR. Эти заместители, обладая электронодонорными свойствами, смещают электронную плотность в сторону бензольного кольца и облегчают вхождение электрофильных реагентов в орто- и пара-положениях. Поэтому такие заместители называют орто- и пара-ориентантами. При действии нуклеофильных реагентов реакция замещения протекает с большим трудом, причем в мета-положении.
2. Заместители (ориентанты) второго рода: -CN, -COOH, -SO3H, -CHO, -COR, -COOR, -NO2, -NH3, -CCl3. Эти заместители смещают электронную плотность от бензольного кольца, т.е. они обладают электроноакцепторными свойствами. Эти заместители дезактивируют бензольное кольцо и электрофильные реагенты будут ориентированы в мета-положении. Такие заместители называют мета-ориентантами. В то же время заместители второго рода облегчают реакции с нуклеофильными реагентами, способствуя орто- и пара-ориентации.
2. Реакции присоединения. Эти реакции протекают с большим трудом. Только в особых условиях (высокая температура, облучение УФ светом, катализатор) бензол может проявлять слабо выраженный непредельный характер и присоединять водород или галогены. Например, в присутствии катализатора (платина, никель или палладий) бензол вступает в реакцию гидрирования с образованием циклогексана
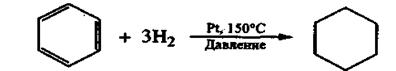
При освещении УФ-светом к бензолу можно присоединить хлор. В результате образуется гексахлорциклогексан (гексахлоран)

3. Реакции окисления. Бензол довольно устойчив к действию окислителей, он не обесцвечивает раствор перманганата калия. Только сильные окислители (например, кислород воздуха при высокой температуре в присутствии V2О5) могут привести к разрыву бензольного кольца с образованием малеиновой кислоты или малеинового ангидрида
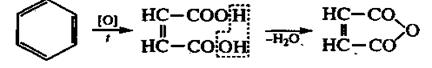
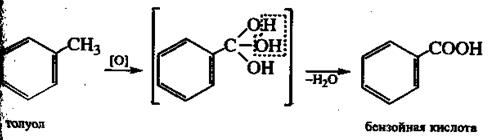
Гомологи бензола окисляются легко. При этом окисляется связанная с бензольным ядром боковая цепь, которая превращается в карбоксильную группу
На воздухе бензол горит коптящим пламенем
2С6Н6 + ЗО2 → 12С + 6Н2О
 2015-08-21
2015-08-21 824
824








