Zn-2e®Zn2+ Cu-2e®Cu2+
Zn½ZnSO4 Сu½CuSO4
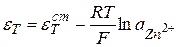
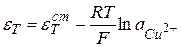 .
.
Электродом второго рода называется электрод, потенциал которого определяется активностью аниона. Он состоит из металла, погруженного в насыщенный раствор своей плохо растворимой соли, куда добавлена хорошо растворимая соль или кислота с тем же анионом.
Допустим, что серебряная пластина погружена в раствор KCl, в который помещен AgClТВ (нерастворимая в воде соль):
Ag+Cl- -1e®AgCl(ТВ)
Потенциал электрода
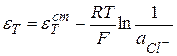
Схематично, такой электрод изображается следующим образом:
Ag, AgClтв½Cl-
Электродом третьего рода (газовым электродом) называется электрод, потенциал которого определяется парциальным давлением газа и активностью аниона или катиона, соответствующего газу. Он состоит из металла (платины), погруженной в раствор хорошо растворимой соли, щелочи или кислоты, с анионом или катионом, соответствующим газу.
Например, водородный электрод, устроен следующим образом:
водород обдувает платиновую пластину, погруженную в раствор кислоты.
Суммарная реакция на электроде: 1/2H2-e®H+.
Гальванические элементы, составленные из электродов на которых протекают процессы окисления и восстановления разных элементов и/или из разных состояний, называются химическими, т.к. движущая сила процесса в них ‑ химическая реакция.
Если гальванический элемент создан из одинаковых электродов, отличающихся только активностью (концентрацией) участников реакции, то гальванический элемент называется концентрационным.
Например: Сu½CuSO4 (0,1m)½CuSO4 (1m)½Сu.
ЭДС такого элемента описывается следующим уравнением:
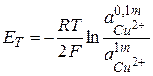 .
.
 2015-08-21
2015-08-21 758
758








