Диссоциация вещества ‑ это способность вещества к распаду на составляющие его части. В определенных условиях некоторые вещества способны полностью или частично распадаться на ионы. Так, в водных растворах неорганические соли, щелочи и кислоты распадаются на ионы практически полностью (сильные электролиты), а органические ‑ частично (слабые электролиты). Введем две характеристики процесса диссоциации.
Степень диссоциации ‑ отношение числа распавшихся молекул (ni*) данного вещества на ионы к общему числу молекул этого вещества (ni)
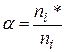 .
.
Для бинарного электролита (AB) концентрация ионов в растворе может быть выражена через общую концентрацию растворенного вещества (С) следующим способом: 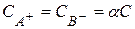 .
.
Для вещества с формулой АB3: 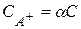 ;
; 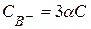 .
.
Для слабых электролитов a<<1, а для сильных a£1.
Константа диссоциации (Кд) ‑ это константа равновесия процесса диссоциации. Например, для вещества AB, диссоциирующего по уравнению AB®A++B-
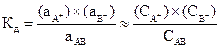 ,
,
причем все активности (концентрации), должны быть взяты в момент равновесия.
Для вещества АB3: 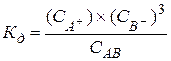
Связь константы диссоциации со степенью диссоциации:
для АВ: 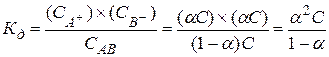
для АВ3: 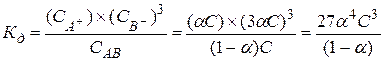
Зависимость степени диссоциации от концентрации (для бинарного электролита):
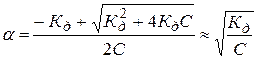 .
.
Последнее справедливо только для слабых электролитов, когда a<<1.
Электропроводность электролитов. В электролите движение заряженных частиц можно описать как равномерное и прямолинейное. Скорость иона 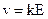 ; k ‑ абсолютная подвижность иона, которая зависит от иона и среды, в которой он движется.
; k ‑ абсолютная подвижность иона, которая зависит от иона и среды, в которой он движется.
Абсолютная подвижность иона ‑ это скорость движения иона в поле с единичной напряженностью. Размерность k‑ см2/(В×с).
Подвижность иона ‑ это произведение абсолютной подвижности иона на постоянную Фарадея: 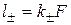 . Размерность l -‑ Ом-1×см2/г-экв.
. Размерность l -‑ Ом-1×см2/г-экв.
При малых концентрациях подвижность практически не зависит от концентрации, а при больших падает с ростом концентрации.
Удельная электропроводность электролита (k) ‑ это электропроводность 1см3 раствора находящегося между двумя параллельными электродами, расположенными на расстоянии 1 см друг от друга. Размерность Ом-1см-1.
Удельная электропроводность электролитов равна произведению концентрации ионов в растворе на скорость переноса заряда в поле единичной напряженности через единичное сечение: 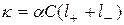 . С учетом перевода концентрации из см3 в литры (1/1000):
. С учетом перевода концентрации из см3 в литры (1/1000):
‑ для слабых электролитов: 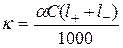 ;
;
‑ для сильных: 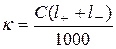 .
.
При малых концентрациях удельная электропроводность сильных электролитов прямо пропорциональна концентрации, а для слабых бинарных электролитов зависимость корневая.
Т.к. при больших концентрациях подвижность ионов уменьшается, то удельная электропроводность начинает уменьшаться с ростом концентрации.
Из зависимости k(с) для сильных электролитов видно, что при малых концентрациях величина 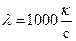 постоянна.
постоянна.
Эквивалентная электропроводность (l) ‑ это электропроводность объема раствора, содержащего 1 г-экв вещества,находящегося между двумя параллельными электродами, расположенными на расстоянии 1 см друг от друга.
Для сильных электролитов a»1 и l=l++l-=l¥.
l¥ ‑ эквивалентная электропроводность при бесконечном разведении. Это выражение справедливо и для слабых электролитов при концентрации стремящейся к нулю. Таким образом, для слабых электролитов:
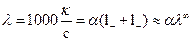 .
.
Измеряя значения l, как функции концентрации при малых концентрациях, можно определить значение степени и константы диссоциации.
 2015-08-21
2015-08-21 850
850







