С молекулярной точки зрения газ представляет собой большое число N свободно перемещающихся частиц (молекул или атомов). Эти частицы движутся с различными скоростями; сталкиваясь, они меняют свои скорости и направление движения.
Количество вещества n = m / m измеряется в молях. Здесь: m - масса газа; m - молярная масса. Молярная масса - число килограммов (граммов) вещества, численно равное его молекулярному весу. Экспериментально установлено, что в 1 моле любого вещества находится одинаковое число молекул. Это число называется числом Авогадро (NA):
NA = 6,02.1023 1/ моль, 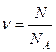
Известно, что при нормальных условиях один моль газа занимает объем равный 22,4 л.
Температура характеризует среднюю кинетическую энергию теплового движения молекул или атомов и прямо пропорциональна ей. Кинетическая энергия теплового движения определяется по среднеквадратичной скорости теплового движения. Таким образом, температура прямо пропорциональна квадрату среднеквадратичной скорости теплового движения молекул.
Температура в физике измеряется в градусах Кельвина (К). Связь между применяемой в быту шкалой Цельсия (С) и абсолютной температурой (шкала Кельвина) определяется соотношением:
Т = t + 273, (4,1)
где Т – температура в К;
t - температура в С.
Свойства большинства веществ, находящихся в газообразном состоянии, при обычных условиях хорошо описываются уравнением
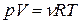 ;
; 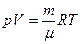 . (4.2)
. (4.2)
Это уравнение называется уравнением состояния идеального газа или уравнением Клайперона-Менделеева.
Здесь: p – давление газа, V – объем в м3, занимаемый m килограммами газа, μ - молярная масса, R – универсальная газовая постоянная, Т – температура по абсолютной шкале.
В системе СИ величина R = 8,31 Дж/(моль.К), давление p, определяемое как сила, действующая на единицу площади, измеряется в Н/м2 или Паскалях (Па) (1 Па = 1 Н/м2).
В термодинамике принято различать три основных процесса, в каждом из которых у заданного количества газа (n = const) не изменяется один из параметров, входящих в формулу (4.2):
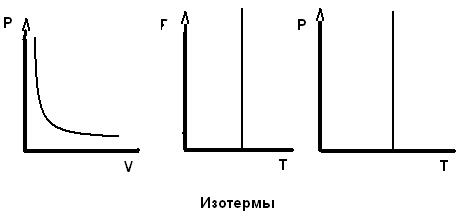
- Изотермический процесс. Это процесс, в котором не изменяется температура газа, т.е Т = const.
В этом случае, при неизменной массе данного газа, уравнение (4.2) примет вид:
pV = const;
или 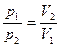 . (4.4)
. (4.4)
Здесь и далее индекс «1» относится к начальному состоянию газа, а индекс «2» - к конечному. Графики этого процесса в различных координатах приведены на рисунке ниже.
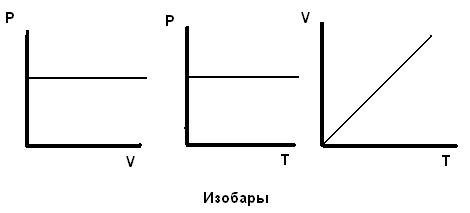
- Изобарный или изобарический процесс. В этом процессе не изменяется давление газа, р = const.
В этом случае, при неизменной массе данного газа, уравнение (4.2) примет вид:
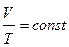 ,
,
или
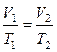 . (4.5)
. (4.5)
Графики этого процесса приведены на рисунке ниже.
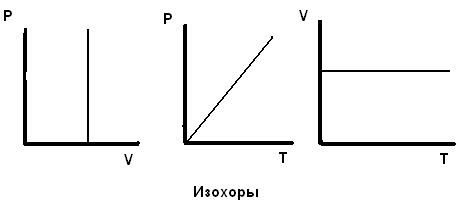
- Изохорный или изохорическийпроцесс. Это процесс протекающий в постоянном объеме, т.е. при V = const. В этом случае, при неизменной массе данного газа, уравнение (4.2) примет вид
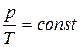 ,
,
или
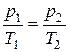 . (4.6)
. (4.6)
Графики этого процесса приведены на рисунке:
ВОПРОСЫ И ЗАДАЧИ
1. Как изменится температура газа, если среднеквадратичная скорость его молекул увеличится в 2 раза?
2. Как изменится среднеквадратичная скорость газа, если температура газа уменьшилась в 3 раза?
3. Масса газообразного водорода в сосуде равна 2 грамма. Сколько примерно молекул водорода находится в сосуде.
4. Какое примерно значение температуры по шкале Цельсия соответствует температуре 200 К?
5. Как изменится давление газа при увеличении концентрации его молекул в 3 раза, если среднеквадратичная скорость молекул остается неизменной.
6. В двух сосудах одинакового объема находятся разные газы при одинаковой температуре. В первом сосуде водород, во втором – кислород. Чему равно отношение числа молекул водорода к числу молекул кислорода, если давление газов одинаково?
7. В одном сосуде находится гелий, в другом водород. Концентрация молекул газов
в обоих сосудах одинакова. Какое из приведенных ниже соотношений для температуры гелия Т 1 и водорода Т 2 справедливо, если давление газов одинаково?
А - Т 1 £ Т 2; Б - Т 1³ Т 2; Г - Отношение зависит от давления; Д - Т 1 = 2 Т 2.
 2015-09-07
2015-09-07 1159
1159








