Так называется процесс, проходящий при постоянном давлении (р = const). При изобарическом процессе выполняется закон Гей-Люссака
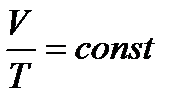 .
.
Для двух состояний газа это уравнение запишется в виде:
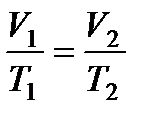 .
.
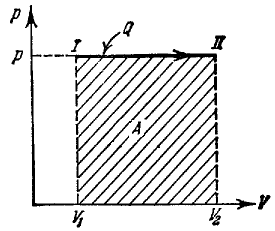
Рис. 37. pV-диаграмма изобарического процесса
На pV -диаграмме этот процесс изображается горизонтальной прямой, параллельной оси V (рис. 37). Работа при изобарическом расширении изображается на этом графике площадью прямоугольника
A = pΔV = (V2 – V1) (101)
Применим к рассматриваемому процессу первое начало термодинамики:
Q = ΔU + A (102)
Подводимое к газу тепло частично тратится на увеличение его внутренней энергии (на нагревание), а частично — на совершение работы. Молярная теплоемкость при изобарическом процессе равна
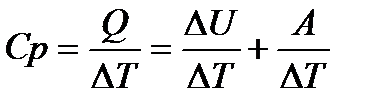 . (103)
. (103)
Но величина ΔU/ΔT от вида процесса не зависит, поскольку внутренняя энергия идеального газа V не зависит ни от р, ни от V, а определяется только величиной Т. Следовательно, изменение внутренней энергии идеального газа с изменением температуры ΔU/ΔТ одинаково при любых процессах, и мы можем, в соответствии с (82), заменить в (103) ΔU/ΔT на Cv:

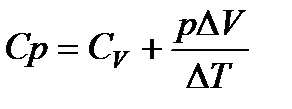 . (104)
. (104)
Как было доказано ранее, для идеального газа

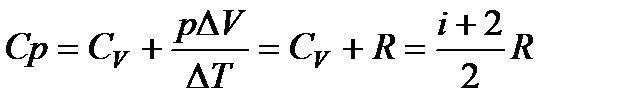 . (105)
. (105)
При изобарическом сжатии направление процесса меняется на обратное, и работа, совершенная газом, становится отрицательной (A<0). Это означает, что не газ совершает внешнюю работу, а, напротив, внешние силы совершают положительную работу А' по сжатию газа, т. е.
A'= – A. (106)
Величины Δ U и Q при этом также отрицательны, т. е. внутренняя энергия газа уменьшается за счет отдачи им тепла окружающим телам.
 2015-02-15
2015-02-15 2608
2608








