1) заряд ядра и суммарный заряд электронов увеличиваются
2) – сила притяжения между ядром и электронами возрастает;
2) число энергетических уровней остается постоянным;
3) у элементов больших периодов заполняется d -подуровень
(а начиная с 6 периода и f -подуровень) – действует эффект
d - и f -сжатия.
В конечном итоге: сила притяжения между ядром и
электронами возрастает, радиус атома уменьшается,
потенциал ионизации увеличивается, восстановительная
активность снижается, усиливаются окислительные
свойства и электроотрицательность.
(по группам сверху вниз)(-s,-p):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается,
электроны удаляются от ядра, и сила притяжения уменьшается;
3) d - и f -сжатие действует слабо, так как эти электроны
остаются во внутренних оболочках.
Таким образом по группе сверху вниз: радиус атома
увеличивается; потенциал ионизации уменьшается,
восстановительная активность возрастает, а окислительные свойства и электроотрицательность уменьшаются.
d -элементов по группе сверху вниз (правая часть d -семейства):
1) заряд ядра и суммарный заряд электронов возрастают;
2) число энергетических уровней увеличивается, но
незначительно;
3) очень сильно действует эффект d и f -cжатия, так как d - и f - подуровни все более близки к заполнению.
В результате – радиус атома уменьшается, потенциал
ионизации возрастает, восстановительная активность
уменьшается, электроотрицательность также уменьшается.
9. Положения Бутлерова:
1) химическая связь обладает специфической особенностью – насыщаемостью, поэтому валентность элемента выражается числом связей его атома;
2) единицы химической связи графически обозначаются черточками – валентными штрихами.
3) химическая природа вещества зависит от его строения и, наоборот, определенному строению отвечает определенная совокупность свойств;
4) все атомы, входящие в молекулу, связанные друг с другом взаимно влияют друг на друга.
10. Согласно методу ВС возможно два способа для образования ковалентных связей:
1) за счёт спаривания неспаренных электронов невозбуждённого или возбуждённого атома;
2) по донорно-акцепторному механизму, т.е. в результате образования общей для двух атомов орбитали при перекрывании заполненной двумя электронами орбитали одного атома со свободной орбиталью другого атома.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: 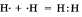 (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Неполярная ковалентная O2, N2, Cl2
Полярная ковалентная HCl, H2O, NH3
11. И онная связь осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов.
ионную связь образуют атомы типичных металлов и атомы типичных неметаллов, резко отличающиеся друг от друга по электроотрицательности.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью
металлическая связь – многоцентровая химическая связь с дефицитом электронов в твердом или жидком веществе, основанная на обобществлении внешних электронов атомов.
– металлическую связь образуют атомы металлов.
механизм образования связи: атом металла отдает наружные электроны, превращаясь в катионы; ионы металлов не в состоянии связать электроны из-за огромной скорости их движения. Поэтому электроны, движущиеся в металле, являются общими для всех ионов металлов.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1]
Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
12. Система, в которой возможен массо‑ и теплообмен между всеми её частями называется термодинамической. В зависимости от характера взаимодействия системы с окружающей средой различают открытые, закрытые и изолированные системы.
Система, в которой возможен массо‑ и теплообмен между всеми её частями называется термодинамической. В зависимости от характера взаимодействия системы с окружающей средой различают открытые, закрытые и изолированные системы.
Система, состоящая из веществ, находящихся в одной фазе, называется гомогенной ( например: воздух – смесь газов). Система, состоящая из веществ, находящихся в разных фазах называется гетерогенной ( например: молоко, дым).
Состояние системы определяется её параметрами: микроскопическими (на молекулярном уровне – это координаты и импульсы каждой молекулы и др. параметры) и макроскопическими (на уровне описания состояния сразу всей системы).
Состояние системы определяется её параметрами: микроскопическими (на молекулярном уровне – это координаты и импульсы каждой молекулы и др. параметры) и макроскопическими (на уровне описания состояния сразу всей системы).
энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии.
Н = U + p · V
Функции состояния системы ∆ U и ∆ Н не дают возможности судить о направлении процесса. Они указывают лишь то, что энергия изолированной системы постоянна.
Для суждения о направлении процесса введена функция состояния S, которая называется энтропия и является мерой неупорядоченности системы
Согласно второму началу термодинамики: в изолированной системе самопроизвольные процессы протекают в сторону увеличения энтропии.
Энтропия увеличивается с повышением температуры, при превращении вещества из кристаллического состояния в жидкое и из жидкого в газообразное
), при диссоциации, деструкции полимеров и т.д., так как увеличивается беспорядок в системе.
И наоборот процессы, связанные с увеличением упорядоченности – охлаждение, конденсация, отвердевания, сжатие, кристаллизация из растворов, полимеризация сопровождаются уменьшением энтропии.
Для учёта энтальпийного и энтропийного факторов введена функция состояния системы G, называемая свободной энергией Гиббса, являющаяся мерой устойчивости системы при постоянных давлении и температуре:
G = H - TS
В изобарно-изотермических процессах (P=const, T=const) изменение энергии Гиббса при реакции будет равно:
∆ G р,T = ∆ Н – Т ∆ S.
Согласно третьему началу термодинамики: в условиях постоянства температуры и давления, процессы протекают самопроизвольно в сторону уменьшения энергии Гиббса: ∆ G р,T <0.
При низких температурах множитель Т мал (T → 0) и абсолютное значение произведения тоже мало | Т ∆ S | << |∆ Н |. Тогда получим Δ G ≈ Δ H.
При высоких температурах множитель Т велик и абсолютное значение произведения тоже велико | Т ∆ S | >> |∆ Н |. Тогда получим Δ G ≈ – Т ∆ S.
Таким образом, при низких температурах знак Δ G определяется знаком Δ Н, а при высоких – знаком ∆ S. При низких температурах самопроизвольно протекают экзотермические реакции, при высоких – эндотермические реакции, т.е. сопровож-дающиеся увеличением энтропии.
13.При постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ, причем каждая концентрация входит в произведение в степени, равной стехиометрическим коэффициентам.
Для реакции
a1А1 + a2А2 + … + anАn = b1B1 + b2B2 + … + bmBm
закон в общем виде выглядит так:
v=k [А1]a1 ∙ [А2]a2 ∙ … ∙ [Аn]an
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции (рис. 1), выражается в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
Энергия активации необходима для образования неустойчивого активированного комплекса (переходного состояния), существующего очень короткое время. Переходное состояние возникает в ходе как прямой, так и обратной реакции и характеризуется большим запасом энергии. Энергетически оно отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных – на энергию активации обратной реакции. Разность энергий активации прямой и обратной реакции равна тепловому эффекту реакции.
Гомогенной называется система состоящая из одной фазы, гетерогенная – это система, состоящая из нескольких фаз. Примеры гомогенных систем: смеси газов (воздух) или растворы веществ в воде; гетерогенных систем: вода со льдом, уголь в воздухе (выхлопные газы) и т.д..
 2015-09-06
2015-09-06 2201
2201
