Вещества, не расходующиеся в результате реакции, но влияющие на её скорость называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
Различают гомогенный и гетерогенный катализ. В гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газ и раствор). В гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы. Пример гомогенного катализа – каталитическое разложение пероксида водорода в водном растворе на воду и кислород. Примеры гетерогенно-каталитических реакций: окисление диоксида серы в триоксид при контактном методе производства серной кислоты; синтез аммиака при производстве азотной кислоты. Катализаторы, уменьшающие скорость реакции, называются ингибиторами.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции, и реакция проходит по промежуточным стадиям. Образуются другие активированные комплексы, для образования которых требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Т.о., энергия активации реакции понижается.
Катализатор в одно и тоже число раз изменяет и прямую, и обратную реакции.
15. Все химическое реакции можно подразделить на две группы: обратимые и необратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ, могут протекать только в одном направлении. Обратимые реакции протекают не до конца – ни одно из реагирующих веществ не расходуется полностью, могут протекать как в прямом, так и обратном направлениях.
Состояние системы, когда скорости прямой и обратной реакций становятся одинаковыми, называется состоянием химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. Т.о. критерием химического равновесия является равенство скоростей прямой и обратной реакций.
Основные факторы, от которых зависит состояние химического равновесия: температура, давление газов и концентрация растворов. Присутствие катализаторов не влияет на равновесия. Изменение хотя бы одного из этих факторов приводит к смещению химического равновесия.
Общий принцип, определяющий влияние различных факторов на равновесные системы, называемый принципомЛе Шателье (1884 г) или принципом подвижного равновесия, формулируется следующим образом:
если на систему, находящуюся в равновесии оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
16. Растворимость жидкостей в жидкостях обычно увеличивается при повышении температуры и для некоторых сочетаний веществ выше некоторой температуры (т.е. критической температуры растворения) становится неограниченной (например: вода - этанол).
Растворимость газов в жидкостях при повышении температуры всегда уменьшается. При длительном кипячении раствора можно полностью удалить из него растворенный газ.
Растворимость твердых веществ в жидкостях всегда ограничена и обычно увеличивается при повышении температуры.
Давление мало сказывается на растворимости твердых тел и жидкостей, но существенно влияет на растворимость газов, что отражается в законе Генри: При данной температуре концентрация растворенного газа пропорциональна его парциальному давлению:
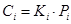 |
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина называется произведением растворимости электролита и обозначается буквами ПР. Она количественно характеризует способность электролита растворяться. Обозначив величину Kc' значением произведения растворимости ПР(PbJ2), получим:
ПР(PbJ2) = [ Pb2 +][ J -]2
17. Под растворомпонимается микроскопически однородная и термодинамически равновесная система, представляющая фазу переменного состава из двух и более взаимодействующих компонентов.
Растворы могут быть: газообразными, жидкими, твердыми.
В этих исследованиях ученый выдвигает идею о химическом характере растворения. При этом отмечает, что в растворе образуется соединение между растворяемым веществом и растворителем. Состав этих веществ зависит от изменения температуры и концентрации. Такие соединения он назвал гидратами в случаях водных растворителей, а в более общей форме – сольватами.
При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяе–мые вещества из более упорядоченного состояния пе–реходят в менее упорядоченноери растворении газов в жидкости энтропия системы обычно уменьшается (ΔS < 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем).
В процессе образования раствора энтальпия систе –мы также может как увеличиваться (NaCI), так и умень–шаться (КОН). Изменение энтальпии процесса раство–рения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо– и экзотермиче–ских вкладов всех процессов, сопровождающих про–цесс растворения. Это эндотермические эффекты раз–рушения кристаллической решетки веществ, разрыва связи молекул, разрушения исходной структуры рас–творителя и экзотермические эффекты образова–ния различных продуктов взаимодействия, в том числе сольватов.
Взаимодействие растворенных частиц с растворителем называется сольватацией. Сольватация в водном растворе называется гидратацией. Ниже показана гидратация ионов Na+ и Cl– при растворении NaСl:
18. Растворы могут быть: газообразными, жидкими, твердыми.
Жидкие растворы по степени дисперсности компонентов, т.е. по размеру частиц подразделяются на:
1) истинные растворы (линейные размеры частиц d<10-7 см)
2) коллоидные растворы (10-7<d<10-5 см)
3) взвеси (d>10-5 см)
Важной характеристикой растворов является концентрации компонентов, т.е. величина, выражающая относительное количество данного компонента.
1. Массовая долевая концентрация: отношение массы данного компонента к массе всей системы умноженное на 100%:
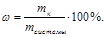 |
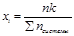 ) Мольная долевая концентрация: отношение числа молей данного компонента к общему числу молей системы:
) Мольная долевая концентрация: отношение числа молей данного компонента к общему числу молей системы:
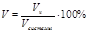 ) Объемная долевая концентрация – отношение объема данного компонента к общему объему системы:
) Объемная долевая концентрация – отношение объема данного компонента к общему объему системы:
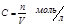 Молярность – число молей растворенного вещество в 1 л раствора:
Молярность – число молей растворенного вещество в 1 л раствора:
Моляльность – число молей растворенного вещества в 1000 г растворителя:
М=n/mp [моль/кг]
) Нормальность – число г-экв растворенного вещества в 1 л раствора:
N=m/(ЭV) [г-экв/л]
где Э – масса 1 г-экв растворенного вещества.
) Титр – число граммов растворенного вещества в 1 мл раствора [г/мл]:
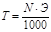 |
19. для воды и разбавленных водных растворов при неизменной температуре произведение концентрации ионов гидроксония H3O+ и гидроксид‑ионов OH- есть величина постоянная. Она называется ионным произведением воды.
В чистой воде при 25˚С [H3O+]=[OH-]=10-7 моль/л. Поэтому
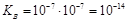
Нейтральный раствор [H3O+]=10-7 моль/л, pH=7
Кислый раствор [H3O+]<10-7 моль/л, pH<7
Щелочной раствор [H3O+]>10-7 моль/л, pH>7.
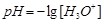 Кислотность и щёлочность разбавленных водных растворов более удобно выражать водородным показателем (обозначается рН), являющимся десятичным логарифмом, взятым с обратным знаком:
Кислотность и щёлочность разбавленных водных растворов более удобно выражать водородным показателем (обозначается рН), являющимся десятичным логарифмом, взятым с обратным знаком:
Например, если [H3O+]=10-5 моль/л, то рН=-lg10-5=5
Аналогично для концентрации гидроксил-ионов вводят гидроксильный показатель:
рОН = - lg[OH-]
В любом водном растворе при 25°С:
pH+pOH=14
Водородный показатель измеряется различными методами. Приближённо реакцию раствора можно определить с помощью специальных реактивов – индикаторов, окраска которых меняется в зависимости от концентрации водородных ионов.
| Наименование индикатора | Цвет индикатора в различных средах | ||
| кислая | нейтральная | щелочная | |
| Метиловый красный | Красный (рН < 4,2) | Оранжевый (4,2<рН<6,3) | Жёлтый (рН>6,3) |
| Метиловый оранжевый | Красный (рН < 3,1) | Оранжевый (3,1<рН<4,4) | Жёлтый (рН>4,4) |
| Лакмус | Красный (рН < 5) | Фиолетовый (5<рН<8) | Синий (рН>8) |
| Фенолфталеин | Бесцветный (рН < 8) | Бледно-малиновый (8<рН<9,8) | Малиновый (рН>9,8) |
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
20. Водные растворы кислот, солей и оснований диссоциируют на ионы, которые проводят электрический ток. Вещества, проводящие электрический ток своими ионами называются электролитами. Электролитами являются растворы солей, кислот и оснований в воде и ряде неводных растворителей, многие расплавленные соли, оксиды и гидроксиды, а также некоторые соли и оксиды в твёрдом состоянии.
Впервые гипотезу распада электролитов на ионы в растворах высказал С. Аррениус в 1887 г. Эти предположения в дальнейшем были развиты в стройную теорию, называемую теорией электролитической диссоциации. Согласно этой теории молекулы электролитов при растворении их в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Например, процесс электролитической диссоциации НСl выражается уравнением:
НСl → Н+ + Cl–.
Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе
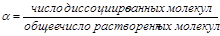 |
Сильные электролиты в водных растворах диссоциируют практически полностью. Истинная степень их диссоциации близка к 1,00 (100%), хотя экспериментально наблюдаемая величина может находиться в пределах от 30% и выше. Электролиты средней силы диссоциируют частично, α от 3% до 30%. Слабые электролиты диссоциируют на ионы в малой степени, в растворах они находятся, в основном, в недиссоциированном состоянии (в молекулярной форме), α менее 3%.
К сильным электролитам принадлежат сильные кислоты (HI, HBr, HCl, HNO3, H2SO4 и др..), сильные основания (гидроксиды щелочных и щелочноземельных металлов) и большая часть солей.
К слабым электролитам принадлежат в первую очередь слабые кислоты и слабые основания и немногие соли многозарядных ионов. Сюда относятся большинство органических кислот, фенолы, амины, некоторые неорганические основания и кислоты (угольная, синильная), а также соли – хлорная ртуть, цианистая ртуть и др.
21. В зависимости от величины и знака стандартного электродного потенциала относительно потенциала водородного электрода все металлы можно расположить в ряд напряжений, по взаимному вытеснению металлов
На основании ряда напряжений сделано 2 важных заключения:
1) металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы из водных растворов их солей:
2) металлы, стоящие в ряду напряжений до водорода вытесняют его из кислот:
Mg + HCl → MgCl2 + H2↑
(Из ряда стандартных электродных потенциалов можно сделать следующие выводы:
- Чем меньше величина электродного потенциала металла, тем сильнее выражены восстановительные свойства атомов,то есть тем активнее металл.
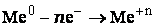
- Чем больше величина потенциала, тем сильнее выражены окислительные свойства ионов металлов.
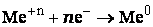
- Более активный металл вытесняет менее активный из раствора его соли.
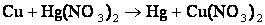
- Металл, стоящий до водорода, вытесняет водород из растворов кислот
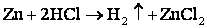
)
22. Электролиз – это окислительно-восстановительное разложение вещества под действием приложенной к нему разности потенциалов.
При электролизе на аноде происходит окисление, на катоде – восстановление.
Многие металлы получаются электролизом из их солей.
Электролиз проводится из растворов или расплавов.
 2015-09-06
2015-09-06 656
656








