Материал анода при электролизе может окисляться, поэтому разделяют электролиз с инертным анодом и активным анодом.
Инертным называется анод, материал которого не окисляется (уголь, платина, графит).
Активным называется анод, материал которого окисляется.
В чистой воде на аноде идет процесс:
2 H2O → O2 + 4 H+ + 4 e-, φ1 = 1,23 В
Количественно электролиз описывается двумя законами Фарадея:
1) Масса выделяющегося на электроде вещества пропорциональна количеству электричества, протекшего через электролизер.
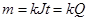 |
J – ток, t – время протекания. Q = Jt – количество электричества, протекшего через электролизер.
k – коэффициент пропорциональности (зависит от системы единиц).
2) Для выделения на электроде 1 г-экв любого вещества необходимо затратить одно и тоже количество электричества, равное числу Фарадея:
Масса выделяющегося на электроде вещества:
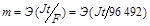 |
23. Элементы, у которых при протекании ОВР понижается степень окисления, называются окислителями. Сами они при этом восстанавливаются.
Элементы, у которых в ходе ОВР повышается степень окисления, называются восстановителями. Они отдают электроны.
Окислители, как правило, вещества в высшей степени окисления:
Восстановители – это соединения в низших степенях окисления:
Применяют два метода нахождения коэффициентов в ОВР:
1) метод электронного баланса,
2) ионно-электронный метод
24.
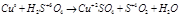 1) Межмолекулярные. В этих реакциях атомы элемента окислителя и восстановителя находятся в разных молекулах.
1) Межмолекулярные. В этих реакциях атомы элемента окислителя и восстановителя находятся в разных молекулах.
2) Внутримолекулярные. В этих реакциях окислитель и восстановитель входят в состав одной молекулы.
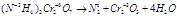 |
3) Реакции диспропорционирования или самоокисления – самовосстановления. Один и тот же элемент является окислителем и восстановителем.
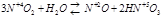 |
Электродные потенциалы зависят от природы веществ, участвующих в электродном процессе, от соотношения между активностями этих веществ и температуры. Для разбавленных растворов, эта зависимость выражается уравнением Нернста в следующей форме:
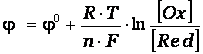
где 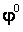 - стандартный электродный потенциал данного процесса,
- стандартный электродный потенциал данного процесса, 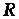 = 8,31 Дж/(мольК) - универсальная газовая постоянная,
= 8,31 Дж/(мольК) - универсальная газовая постоянная, 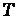 - абсолютная температура раствора,
- абсолютная температура раствора, 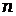 - число молей электронов передаваемых в процессе,
- число молей электронов передаваемых в процессе, 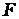 = 96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах. В общем случае в уравнении Нернста вместо концентраций необходимо использовать активности веществ.
= 96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах. В общем случае в уравнении Нернста вместо концентраций необходимо использовать активности веществ.
25. Коррозией называется процесс разрушения металла под химическим воздействием соприкасающейся с ним среды
Виды коррозии: равномерная, пятнами, точечная, межкристаллическая, межкристаллитная, растрескивающаяся, селективная.
Коррозия – это окислительно восстановительный процесс, может протекать в газах, в воздухе, в воде, в органических растворителях и в растворах электролитов.
Различают – химическую и электрохимическую коррозию. Масштабы потерь от коррозии составляют миллиарды рублей.
Химическая коррозия протекает при действии на них окислителей- неэлектролитов. Химическую коррозию иногда называют газовой или высокотемпературной. Металл покрывается слоем продуктов своего окисления – чаще всего пленкой оксида или гидроксида. Оксидная пленка иногда препятствует дальнейшему окислению.
Разрушение металла в среде электролита с возникновением внутри системы электрического тока называется электрохимической коррозией. Практически любой металл имеет примеси других металлов и образует в среде электролита большое число микрогальванических элементов. Если два металла соединить вне раствора проводником и поместить в раствор, содержащий их ионы, то более активный металл будет корродировать. Причиной коррозии электрохимических металлов в первую очередь может быть вода.
1) Изоляция металла от коррозийной среды.
Создается защитная пленка на поверхности. Например, покрывается металл другим металлом: Cr, Ni, Zn, Sn, Ag и др. не корродирующим металлом. 2) Электрохимические методы защиты:
Протекторная – это защита с использованием специального анода – протектора (например, старые алюминиевые детали или проволока) с меньшим электродным потенциалом, чем электродный потенциал у металла защищаемой конструкцией
Электрозащита – это защита с использованием внешнего источника тока. Здесь защищаемая конструкция подключается к отрицательному полюсу источника тока и становится катодом. В качестве анодов используют проволоку из спец.сплавов. При надлежащей силе тока в цепи на защищаемой конструкции происходит восстановление окислителя, а процеес восстановления претерпевает вещество анода.
3) Ингибиторы коррозии
 2015-09-06
2015-09-06 538
538







